
����Ŀ����Ԫ�ػ��ϼۺ�������������Ƕ�ѧϰ���о����ʵ����ʣ���һ����֮��Ч�ķ�������������Ԫ���γ����ʵĶ�άͼ�IJ�����Ϣ��
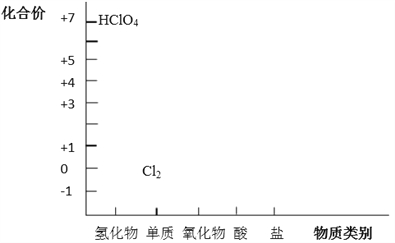
��1������ͼ����Ϣ��д�����������ȵ�������Ļ�ѧʽ_____________��
��2��д�������ᣨHClO4����NaOH��Ӧ�Ļ�ѧ����ʽ__________��
��3��HCl�Ⱦ��������ԣ��־��л�ԭ�ԡ�
��������д��һ������HCl�����Ե����ӷ���ʽ__________��
��ŨHCl����Ϊ��ԭ���ڼ�����������MnO2������Ӧ�Ʊ�Cl2��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��4��Cl2�Ⱦ��������ԣ��־��л�ԭ�ԣ�������ͼ˵��ԭ��_________����ʪ��Cl2��Na2CO3�����ȡ����Cl2O�ķ�Ӧ�У�Cl2�������������ԣ�Ҳ�����˻�ԭ�ԡ�д����Ӧ�Ļ�ѧ����ʽ_________��
���𰸡� Cl2O��Cl2O3��ClO2��Cl2O5��Cl2O7������������ HClO4+NaOH=NaClO4+H2O Zn+2H+=Zn2++H2�� Fe+2H+=Fe2++H2�� MnO2+4HCl��Ũ![]() MnCl2+Cl2��+2H2O Cl2��ClԪ�ػ��ϼ�Ϊ0�ۣ���Ԫ�ػ���-1���Լ�+1�ȼ�̬�������Ԫ�ػ��ϼۿ������ߣ��������ֻ�ԭ�ԣ���Ԫ�ػ��ϼۿ��Խ��ͣ��������������ԡ� 2Cl2+2Na2CO3+H2O��2NaHCO3+2NaCl+Cl2O
MnCl2+Cl2��+2H2O Cl2��ClԪ�ػ��ϼ�Ϊ0�ۣ���Ԫ�ػ���-1���Լ�+1�ȼ�̬�������Ԫ�ػ��ϼۿ������ߣ��������ֻ�ԭ�ԣ���Ԫ�ػ��ϼۿ��Խ��ͣ��������������ԡ� 2Cl2+2Na2CO3+H2O��2NaHCO3+2NaCl+Cl2O
����������1������ͼ����Ϣ��֪��Ԫ�صij��������ϼ���+1��+3��+4��+5��+7��������ȵ�������Ļ�ѧʽ��Cl2O��Cl2O3��ClO2��Cl2O5��Cl2O7�ȡ���2�������ᣨHClO4����һԪǿ�ᣬ��NaOH��Ӧ�Ļ�ѧ����ʽΪHClO4+NaOH=NaClO4+H2O����3���ٽ��������ᷴӦ�������������Ȼ���Ļ�ԭ�ԣ�����Zn+2H+=Zn2++H2����Fe+2H+=Fe2++H2��������ŨHCl����Ϊ��ԭ���ڼ�����������MnO2������Ӧ�Ʊ�Cl2���÷�Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ![]() MnCl2+Cl2��+2H2O����4��Cl2��ClԪ�ػ��ϼ�Ϊ0�ۣ���Ԫ�ػ���-1���Լ�+1�ȼ�̬�������Ԫ�ػ��ϼۿ������ߣ��������ֻ�ԭ�ԣ���Ԫ�ػ��ϼۿ��Խ��ͣ��������������ԣ���Cl2�Ⱦ��������ԣ��־��л�ԭ������ʪ��Cl2��Na2CO3�����ȡ����Cl2O�ķ�Ӧ�У�Cl2�������������ԣ���ԭ�������Ȼ��ƣ���Ҳ�����˻�ԭ�ԣ�����������Cl2O������˸���ԭ���غ��Լ����ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ2Cl2+2Na2CO3+H2O��2NaHCO3+2NaCl+Cl2O��
MnCl2+Cl2��+2H2O����4��Cl2��ClԪ�ػ��ϼ�Ϊ0�ۣ���Ԫ�ػ���-1���Լ�+1�ȼ�̬�������Ԫ�ػ��ϼۿ������ߣ��������ֻ�ԭ�ԣ���Ԫ�ػ��ϼۿ��Խ��ͣ��������������ԣ���Cl2�Ⱦ��������ԣ��־��л�ԭ������ʪ��Cl2��Na2CO3�����ȡ����Cl2O�ķ�Ӧ�У�Cl2�������������ԣ���ԭ�������Ȼ��ƣ���Ҳ�����˻�ԭ�ԣ�����������Cl2O������˸���ԭ���غ��Լ����ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ2Cl2+2Na2CO3+H2O��2NaHCO3+2NaCl+Cl2O��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��֪��A��B��C��D����Ԫ�أ�ԭ��������������A�Ƕ�����Ԫ���н�������ǿ��Ԫ�أ�BԪ��3p�ܼ��������C���������ڵ縺������Ԫ�أ�D�ǵ�������δ�ɶԵ�������Ԫ�ء��Իش������й����⣺
��1��д��DԪ�ؼ۵��ӵĵ����Ų�ʽ��
��2��D���γɻ�����[D(H2O)6](NO3)3��
��[D(H2O)6](NO3)3�������ӵ����幹������NO3����ԭ�ӵĹ���ӻ�����Ϊ��
����[D(H2O)6]3+��D3+��H2O֮���γɵĻ�ѧ����Ϊ �� 1 mol [D(H2O)6] 3+�к��еĦҼ���mol��
��3����֪B��C����Ԫ���γɵĻ�����ͨ�������֡������ֻ�������(�ѧʽ)Ϊ�Ǽ��Է��ӡ���һ�����ʵĵ���ʽΪ��
��4����A��C��Ԫ���γɵĻ�������ɵľ����У����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С�������ͼ��ʾΪA��C�γɻ�����ľ����ṹͼ�Լ�����������ͼ��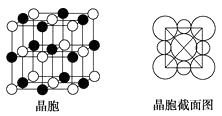
�����о���һ��A+�����C��������ЩCΧ�ɵ�ͼ�������������ܶ�Ϊ�� g��cm3 �� �����ӵ�������ֵ��NA��ʾ����A+�����Ӱ뾶Ϊcm(�ú�NA������ʽ�ӱ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. Cl2��2KBr=Br2��2KCl
B. 2NH4Cl + Ca(OH )2![]() CaCl2 +2NH3��+ 2H2O
CaCl2 +2NH3��+ 2H2O
C. 3Mg��N2![]() Mg3N2
Mg3N2
D. 2Na2O2��2CO2=2Na2CO3��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�ǻ����B�ǽ������ʣ�����֮�����Ӧ�Լ�������֮���ת����ϵ��ͼ��ʾ��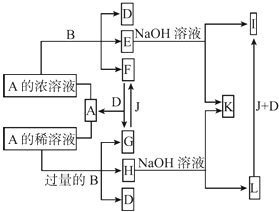
��1������B��Ԫ�����ڱ��е�λ���� �� B��A��Ũ��Һ��Ӧ�������� �� д������B��A��ϡ��Һ��Ӧ�����ӷ���ʽ�� ��
��2��������0.1 mol/L E��ˮ��Һ�и�����Ũ�ȴ�С��ϵΪ ��
��3��Lת��ΪI�������� �� д���йصĻ�ѧ����ʽ�� ��
��4����μ��H��Һ�������ӵĴ��ڣ�д��ʵ����������������ۣ� ��
��5����֪25��ʱFe��OH��3��Ksp=3.5��10��39 �� �ֽ�4.0��10��8 mol/L E��Һ��2.0��10��8 mol/L NaOH��Һ�������ϣ�������Һ���ʱ����ı仯����ͨ����ʽ����˵���Ƿ��г��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X��4����ѧ��ѧ�г��������ʣ���ת����ϵ������ͼ�����ֲ�������ȥ��������˵���У���ȷ���ǣ� �� 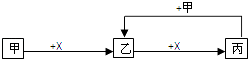
A.����Ϊ�����������һ��ΪFeCl3
B.����Ϊǿ���Xһ��ΪCO2
C.������һ�ְ�ɫ��״�����������Һ��һ������Al3+
D.����Ϊ���ʣ���˹�ϵ���漰�ķ�Ӧһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��7.2 g H2O�����е�����������ٿ�H2SO4��������ԭ������ȣ�����������ԭ����֮���Ƕ��٣���ԭ����֮���Ƕ��١���Ҫ������̣�____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ��CH3COCH3+Br2 ![]() CH3COCH2Br+HBr�����о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ����v��Br2��ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br+HBr�����о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ����v��Br2��ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/molL��1 | ����ɫ��ʧ�����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ��۲���ȷ���ǣ� ��
A.����c��CH3COCH3����v��Br2������
B.ʵ��ں͢۵�v��Br2�����
C.����c��HCl����v��Br2������
D.����c��Br2����v��Br2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ�г������ʵ�ת����ϵͼ�У���Ӧ���������ַ�Ӧ��Ͳ���δȫ��ע������֪A��DΪ�������ʣ�����Ϊ�������B�Ǻ�ɫ���ʣ���һ�ֿ�ʯ����Ҫ�ɷ֣�
���ƶϣ�
��1��A��ԭ�ӽṹʾ��ͼΪ �� д��B�Ļ�ѧʽ�� �� д��C�Ļ�ѧʽ�� �� ��Ҫ�ɷ���J�Ŀ�ʯ�����ƣ� ��
��2���ڷ�ӦF��E�У�ҪʹF�е�һ�ֽ���Ԫ��ȫ���Գ�������ʽ�����������˼���ķ�Ӧ���� �� Dͨ�����Ϸ�Ӧת��ΪGӦ����ķ�Ӧ��Ϊ �� F��E����Һ��Ϻ�������� ��
��3��д�����з�Ӧ�ķ���ʽ��H��I�Ļ�ѧ����ʽ �� C��F�����ӷ���ʽ �� F��E�����ӷ���ʽ ��
��4������G��Һ�����������ӵķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���SO42-��CO32-��Cl����Ϊ�˼��������Ƿ���SO42-����BaCl2��Һ�⣬����Ҫ����Һ�ǣ� ��
A. H2SO4B. ����
C. NaOHD. NaNO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com