
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��֪��A��B��C��D����Ԫ�أ�ԭ��������������A�Ƕ�����Ԫ���н�������ǿ��Ԫ�أ�BԪ��3p�ܼ��������C���������ڵ縺������Ԫ�أ�D�ǵ�������δ�ɶԵ�������Ԫ�ء��Իش������й����⣺
��1��д��DԪ�ؼ۵��ӵĵ����Ų�ʽ��
��2��D���γɻ�����[D(H2O)6](NO3)3��
��[D(H2O)6](NO3)3�������ӵ����幹������NO3����ԭ�ӵĹ���ӻ�����Ϊ��
����[D(H2O)6]3+��D3+��H2O֮���γɵĻ�ѧ����Ϊ �� 1 mol [D(H2O)6] 3+�к��еĦҼ���mol��
��3����֪B��C����Ԫ���γɵĻ�����ͨ�������֡������ֻ�������(�ѧʽ)Ϊ�Ǽ��Է��ӡ���һ�����ʵĵ���ʽΪ��
��4����A��C��Ԫ���γɵĻ�������ɵľ����У����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С�������ͼ��ʾΪA��C�γɻ�����ľ����ṹͼ�Լ�����������ͼ��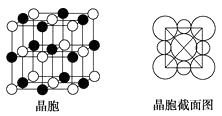
�����о���һ��A+�����C��������ЩCΧ�ɵ�ͼ�������������ܶ�Ϊ�� g��cm3 �� �����ӵ�������ֵ��NA��ʾ����A+�����Ӱ뾶Ϊcm(�ú�NA������ʽ�ӱ���)��
���𰸡�
��1��3d54s1
��2��ƽ�������Σ�sp2�ӻ�����λ����18
��3��PCl5��![]()
��4��6���������壻![]()
���������⣺A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ���AΪ��Ԫ�أ�BԪ��3p�ܼ��������ԭ��������A����BΪ��Ԫ��;D�ǵ�������δ�ɶԵ�������Ԫ�أ���D�ĵ����Ų�Ϊ[Ar]3d54s1��Ԫ��Ϊ��;Cֻ��λ�ڵ������ڣ������ڵ縺������Ԫ������Ԫ�ء�(1)DΪ��Ԫ�أ���۵����Ų�Ϊ3d54s1����2����NO3-����ԭ�ӵ�ԭ�ӵļ۵��Ӷ���Ϊ ![]() =3����Nԭ��Ϊsp2�ӻ��������Ӧ�����幹����ƽ�������Ρ�����[D(H2O)6]3+��Cr3+�пյ�ԭ�ӹ������H2O���ӵ���ԭ���й¶Ե��ӣ�H2O�еŶԵ������Cr3+�Ŀչ�����γ���λ����[D(H2O)6]3+��6����λ�����ǦҼ���ÿ��ˮ��������ԭ������ԭ���γɶ����Ҽ������1mol��[D(H2O)6]3+�к���18mol�ĦҼ�,��3��B��
=3����Nԭ��Ϊsp2�ӻ��������Ӧ�����幹����ƽ�������Ρ�����[D(H2O)6]3+��Cr3+�пյ�ԭ�ӹ������H2O���ӵ���ԭ���й¶Ե��ӣ�H2O�еŶԵ������Cr3+�Ŀչ�����γ���λ����[D(H2O)6]3+��6����λ�����ǦҼ���ÿ��ˮ��������ԭ������ԭ���γɶ����Ҽ������1mol��[D(H2O)6]3+�к���18mol�ĦҼ�,��3��B��
C�γɵ����ֳ���������ΪPCl5��PCl3 �� ����PCl5��������ԭ�ӵļ۵���ȫ������ɼ���û�й¶Ե��ӣ���ԭ������ԭ���γɶ�����ۼ����ռ乹��Ϊ����˫�Σ���ɷֲ��Գƣ�������������غϣ������ǷǼ��Է��ӡ�PCl3����ԭ����������������ԭ�ӹ��ã��γ��������ۼ�����һ�Թ¶Ե��ӣ��Ǽ��Է��ӣ������ʽΪ: ![]() ��(4)A��C��Ԫ���γɵĻ�����ΪNaCl���Ӿ����ṹ��������뾶С����Na+ �� ����
��(4)A��C��Ԫ���γɵĻ�����ΪNaCl���Ӿ����ṹ��������뾶С����Na+ �� ����
�뾶�����Cl- �� ��ѡ�����������ĵ�Na+��Ϊ�о�����������Na+�����Cl-�ֱ�λ��6��������ģ���6��Cl-Χ��һ���������塣�����е�1��Na+λ�����ģ�12��Na+�ֱ�λ��12������е㣬���ݾ�̯������øþ���ӵ�е�Na+��Ϊ��1+12�� ![]() =4��������6�������������1��Cl- �� �˸��������һ��Cl- �� ͬ������øþ���ӵ�е�Cl-��Ϊ:6��
=4��������6�������������1��Cl- �� �˸��������һ��Cl- �� ͬ������øþ���ӵ�е�Cl-��Ϊ:6�� ![]() +8��
+8�� ![]() =4���辧���ı߳�Ϊa�������ܶȹ�ʽ�ɵã���-a3=4��
=4���辧���ı߳�Ϊa�������ܶȹ�ʽ�ɵã���-a3=4�� ![]() �����ε�a=
�����ε�a= ![]() ,�Ӿ�������ͼ��:a-2r++2r-��r+��r-�ֱ��ʾNa+��Cl-�İ뾶����4r-=
,�Ӿ�������ͼ��:a-2r++2r-��r+��r-�ֱ��ʾNa+��Cl-�İ뾶����4r-= ![]() ��4r-Ϊ����Խ��߳��ȣ�����r+=
��4r-Ϊ����Խ��߳��ȣ�����r+= ![]() ���˼�Ϊ�����Na+�뾶��
���˼�Ϊ�����Na+�뾶��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.2 g CuͶ��100 mLϡ�����м��ȣ�û�����Ա仯�������ȱ�������һ����H2O2������Cu���ܽ⣬������˵����ȷ����(����)
A. ��Ӧ�������д̼�����ζ����������
B. H2O2��Cu��ϡ����ķ�Ӧ�������
C. ��Cu������ǡ����ȫ��Ӧ����ϡ��������ʵ���Ũ��Ϊ0.5 mol��L��1
D. ��Ӧ������ȱ��ֳ������ֱ��ֳ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ����ܴ�����������ɫ��Һ�е��� �� ��
A. Na+��H+��CO32-��NO3- B. Fe3+��Mg2+��Cu2+��Cl-
C. Na+��OH-��HCO3-��Cl- D. Ba2+��Cl-��NO3-��OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʪ���KI������ֽ�Ӵ�ij���������ɫ���������п�����()
��Cl2��NO2��H2S��SO2��HCl��������
A.�٢ۢ�
B.�٢ڢ�
C.�٢ڢ�
D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.ˮ�����c�� H+��=1xl0��13 mol/L����Һ�У�K+��Na+��SiO ![]() ��SO
��SO ![]()
B.1.0 mol/L��CH3COOH��Һ��K+��Fe3+��NO ![]() ��Cl��
��Cl��
C.��c��OH������c��H+��=1��1012����Һ��NH ![]() ��Ca2+��C1����K+
��Ca2+��C1����K+
D.�����Ի�ɫ����Һ��Na+��CO ![]() ��NO
��NO ![]() ��SO
��SO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2��H2�ϳ�NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� �� 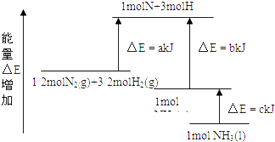
A.N2��g��+3H2��g��2NH3��g������H=2��b��a�� kJ/mol
B.N2��g��+3H2��g��2NH3��l������H=2��a��b��c�� kJ/mol
C.![]() N2��g��+
N2��g��+ ![]() H2��g��NH3��l������H=��b+c��a�� kJ/mol
H2��g��NH3��l������H=��b+c��a�� kJ/mol
D.![]() N2��g��+
N2��g��+ ![]() H2��g��NH3��g������H=��a+b�� kJ/mol
H2��g��NH3��g������H=��a+b�� kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѻӷ��Զ����㣨TaS2���ɲ�������װ���ᴿ����������TaS2��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�У���Ӧ���£�TaS2��s��+2I2��g��TaI4��g��+S2��g������˵����ȷ���ǣ� �� ![]()
A.�ڲ�ͬ�¶�����TaI4�������ֲ���
B.���ᴿ�����У�I2�������ϼ���
C.���ᴿ�����У�I2�������ǽ�TaS2�Ӹ�����ת�Ƶ�������
D.�÷�Ӧ��ƽ�ⳣ����TaI4��S2��Ũ�ȳ˻��ɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ػ��ϼۺ�������������Ƕ�ѧϰ���о����ʵ����ʣ���һ����֮��Ч�ķ�������������Ԫ���γ����ʵĶ�άͼ�IJ�����Ϣ��
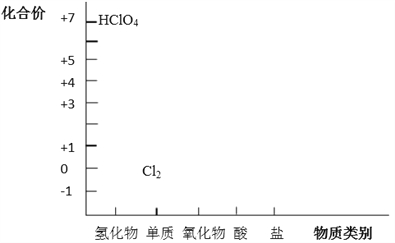
��1������ͼ����Ϣ��д�����������ȵ�������Ļ�ѧʽ_____________��
��2��д�������ᣨHClO4����NaOH��Ӧ�Ļ�ѧ����ʽ__________��
��3��HCl�Ⱦ��������ԣ��־��л�ԭ�ԡ�
��������д��һ������HCl�����Ե����ӷ���ʽ__________��
��ŨHCl����Ϊ��ԭ���ڼ�����������MnO2������Ӧ�Ʊ�Cl2��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��4��Cl2�Ⱦ��������ԣ��־��л�ԭ�ԣ�������ͼ˵��ԭ��_________����ʪ��Cl2��Na2CO3�����ȡ����Cl2O�ķ�Ӧ�У�Cl2�������������ԣ�Ҳ�����˻�ԭ�ԡ�д����Ӧ�Ļ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com