
【题目】下列各组离子,可能大量共存于无色溶液中的是 ( )
A. Na+、H+、CO32-、NO3- B. Fe3+、Mg2+、Cu2+、Cl-
C. Na+、OH-、HCO3-、Cl- D. Ba2+、Cl-、NO3-、OH-
科目:高中化学 来源: 题型:
【题目】a g镁铝合金投入xmL,2mol/L的盐酸中,金属完全溶解,再加入ymL,1mol/L NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是( )
A.镁铝合金与盐酸反应转移电子数为0.1NA
B.沉淀为Mg(OH)2和Al(OH)3混合物
C.x=2y
D.a的取值范围为0.9g<a<1.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890 kJmol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890 kJmol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890 kJmol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程,下列叙述中不正确的是( )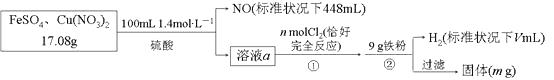
A.n=0.02
B.V=2240
C.m=3.2
D.元混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( ) 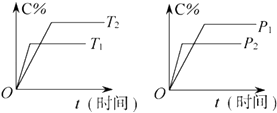
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是。NO3中心原子的轨道杂化类型为。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为 , 1 mol [D(H2O)6] 3+中含有的σ键有mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中(填化学式)为非极性分子。另一种物质的电子式为。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图: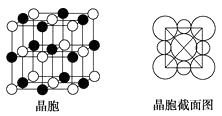
晶胞中距离一个A+最近的C有个,这些C围成的图形是;若晶体密度为ρ g·cm3 , 阿伏加德罗常数的值用NA表示,则A+的离子半径为cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.4.1gH3PO3可与2gNaOH完全反应生成正盐,则H3PO3为__________元酸。该正盐的电离方程式为_________________。
Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3,2片小苏打片能中和胃酸中的H+是_____mol。
(2)胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平__________。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: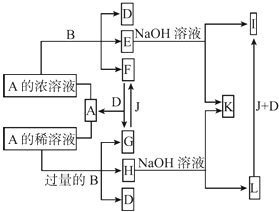
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com