
【题目】可逆反应mA(固)+nB(气)Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( ) 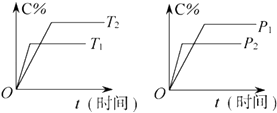
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
【答案】B
【解析】解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T1>T2 , 温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1 , 压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q.
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;
B、由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为气体物质的量增大的反应,即n<P+q,故C错误;
D、A为固体,浓度为定值,达平衡后,增加A的量,平衡不移动,故D错误.
故选B.


科目:高中化学 来源: 题型:
【题目】下列化学反应中,水只做氧化剂的是
A. 2Na+2H2O=2NaOH+H2↑B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2![]() N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为___________。
(3)有一瓶溶液,其中可能含有H+、NH![]() 、K+、Na+、Mg2+、Ba2+、Fe3+、SO
、K+、Na+、Mg2+、Ba2+、Fe3+、SO![]() 、CO
、CO![]() 、Cl―和I―。取该溶液进行以下实验:
、Cl―和I―。取该溶液进行以下实验:
① 用pH试纸检验,表明溶液呈强酸性;
② 取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
③ 另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成;
④ 取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
⑤ 将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实,可知该溶液中肯定含有的离子是______________;肯定没有的离子是________________;还不能确定是否含有的离子是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:(1)C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
(2)CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol
O2(g)═CO2(g)△H=﹣283.0kJ/mol
则反应:C(s)+ ![]() O2(g)═CO(g)的△H 是( )
O2(g)═CO(g)的△H 是( )
A.﹣221 kJ/mol
B.﹣110.5 kJ/mol
C.+110.5 kJ/mol
D.+221 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,可能大量共存于无色溶液中的是 ( )
A. Na+、H+、CO32-、NO3- B. Fe3+、Mg2+、Cu2+、Cl-
C. Na+、OH-、HCO3-、Cl- D. Ba2+、Cl-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿润的KI淀粉试纸接触某气体而显蓝色,该气体中可能有()
①Cl2②NO2③H2S④SO2⑤HCl⑥溴蒸气
A.①③④
B.①②⑤
C.①②⑥
D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( ) 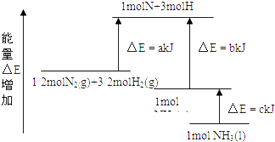
A.N2(g)+3H2(g)2NH3(g);△H=2(b﹣a) kJ/mol
B.N2(g)+3H2(g)2NH3(l);△H=2(a﹣b﹣c) kJ/mol
C.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
D.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(g);△H=(a+b) kJ/mol
H2(g)NH3(g);△H=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~M为中学化学的常见物质,它们之间的转化关系如图所示,部分生成物和反应条件省略.已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.请回答下列问题: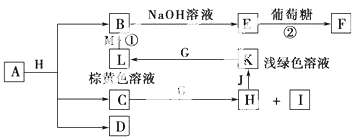
(1)写出A的化学式: .
(2)比较Y与Z的原子半径大小:>(填元素符号).
(3)检验L溶液中金属阳离子的方法是 .
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体.请写出该反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com