
【题目】研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2![]() N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为___________。
(3)有一瓶溶液,其中可能含有H+、NH![]() 、K+、Na+、Mg2+、Ba2+、Fe3+、SO
、K+、Na+、Mg2+、Ba2+、Fe3+、SO![]() 、CO
、CO![]() 、Cl―和I―。取该溶液进行以下实验:
、Cl―和I―。取该溶液进行以下实验:
① 用pH试纸检验,表明溶液呈强酸性;
② 取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
③ 另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成;
④ 取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
⑤ 将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实,可知该溶液中肯定含有的离子是______________;肯定没有的离子是________________;还不能确定是否含有的离子是________________。
【答案】 NO2 46 2CO+2NO![]() N2+2CO2 H+、 Ba2+、 I-、 NH
N2+2CO2 H+、 Ba2+、 I-、 NH![]() CO
CO![]() 、 SO
、 SO![]() 、 Mg2+、 Fe3+ K+、Na+、Cl-
、 Mg2+、 Fe3+ K+、Na+、Cl-
【解析】(1)反应中N元素化合价从+4价降低到0价,得到4个电子,所以氧化剂是NO2;当消耗CH4的体积是11.2 L(标准状况下)时,甲烷的物质的量是0.5mol,根据方程式可知理论上可处理NO2的质量是0.5mol×2×46g/mol=46g。(2)该装置能将CO和NO转化为参与大气循环的无毒气体,应该是氮气和CO2,所以该反应的化学方程式为2CO+2NO![]() N2+2CO2。(3)①用pH试纸检验,表明溶液呈强酸性,含有H+,所以不能存在CO32-;②取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色,说明有单质碘生成,即含有I-;③另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,说明不存在Mg2+、Fe3+;④取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,所以不存在硫酸根离子;⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,气体是氨气,说明存在铵根离子。根据上述实验事实,可知该溶液中肯定含有的离子是H+、Ba2+、I-、NH4+;肯定没有的离子是CO32-、SO42-、Mg2+、Fe3+;还不能确定是否含有的离子是K+、Na+、Cl-。
N2+2CO2。(3)①用pH试纸检验,表明溶液呈强酸性,含有H+,所以不能存在CO32-;②取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色,说明有单质碘生成,即含有I-;③另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成,说明不存在Mg2+、Fe3+;④取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,所以不存在硫酸根离子;⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,气体是氨气,说明存在铵根离子。根据上述实验事实,可知该溶液中肯定含有的离子是H+、Ba2+、I-、NH4+;肯定没有的离子是CO32-、SO42-、Mg2+、Fe3+;还不能确定是否含有的离子是K+、Na+、Cl-。


科目:高中化学 来源: 题型:
【题目】若溶液中由水电离产生的c(OH﹣)=1×10﹣14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.K+、NH ![]() 、SO
、SO ![]() 、NO
、NO ![]()
B.Ca2+、Al3+、HCO ![]() 、Cl﹣
、Cl﹣
C.MnO4﹣、K+、SO ![]() 、Na+
、Na+
D.Na+、Fe2+、NO ![]() 、SCN﹣
、SCN﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答: 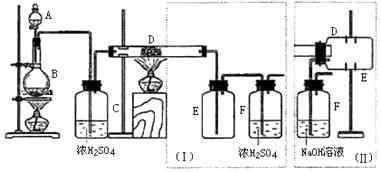
(1)B中反应的化学方程式为:;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是: .
(3)D中反应化学方程式为: .
(4)装置(Ⅰ)的主要缺点是: .
(5)装置(Ⅱ)的主要缺点是: . 如果选用此装置来完成实验,则必须采取的改进措施是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890 kJmol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890 kJmol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890 kJmol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸与次氯酸钙能发生如下反应: Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存较久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是①CO2 ② HCl ③水蒸气 ④O2中的()。
A.①②③
B.②③④
C.②③
D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( ) 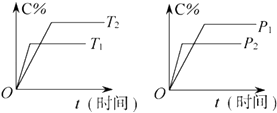
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com