
����Ŀ��ʵ���ҿ����������������Ӧ�Ʊ���ˮ���Ȼ������û��������غ�ɫ���׳��⣬100������ʱ��������ͼ������ѧ����Ƶ�ʵ��װ�á���ߵķ�Ӧװ����ͬ�����ұߵIJ�Ʒ�ռ�װ����ͬ���ֱ��磨�ͣ�����ʾ���Իش� 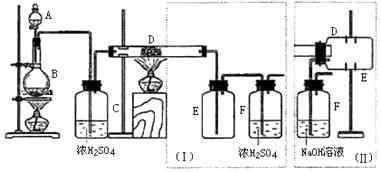
��1��B�з�Ӧ�Ļ�ѧ����ʽΪ����
��2��D�еķ�Ӧ��ʼǰ�����ų�װ���еĿ�����Ӧ��ȡ�ķ����ǣ� ��
��3��D�з�Ӧ��ѧ����ʽΪ�� ��
��4��װ�ã�����Ҫȱ���ǣ� ��
��5��װ�ã�����Ҫȱ���ǣ� �� ���ѡ�ô�װ�������ʵ�飬������ȡ�ĸĽ���ʩ�ǣ� ��
���𰸡�
��1��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2 ��+2H2O
MnCl2+Cl2 ��+2H2O
��2��B�еķ�Ӧ����һ��ʱ���������ɫ�������װ�ã��ٿ�ʼ����D
��3��2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
��4�������ױ���Ʒ������β���������������ɻ�����Ⱦ
��5����Ʒ�׳��⣻��ƿE��F֮������װ�и������װ��
���������⣺��1��ʵ����������������Ӧ��ȡ�Ȼ������������ȱ�����ȡ������ʵ���ҳ���Ũ����Ͷ������̼�����ȡ���������������£�Ũ����Ͷ������̷�Ӧ�����Ȼ��̡�������ˮ������B�з����Ļ�ѧ��Ӧ��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2 ��+2H2O�� �ʴ�Ϊ��4HCl��Ũ��+MnO2
MnCl2+Cl2 ��+2H2O�� �ʴ�Ϊ��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2 ��+2H2O����2��D�еķ�Ӧ��ʼǰ�����ų�װ���еĿ�������ֹ����������Ӧ����������������������ʣ�����D�еķ�Ӧ��ʼǰ�������ų�װ���еĿ������䷽����B�еķ�Ӧ����һ��ʱ���������ɫ�������װ�ã��ٿ�ʼ����D��
MnCl2+Cl2 ��+2H2O����2��D�еķ�Ӧ��ʼǰ�����ų�װ���еĿ�������ֹ����������Ӧ����������������������ʣ�����D�еķ�Ӧ��ʼǰ�������ų�װ���еĿ������䷽����B�еķ�Ӧ����һ��ʱ���������ɫ�������װ�ã��ٿ�ʼ����D��
�ʴ�Ϊ��B�еķ�Ӧ����һ��ʱ���������ɫ�������װ�ã��ٿ�ʼ����D����3�����������£�����������Ӧ�����Ȼ�������Ӧ����ʽΪ2Fe+3Cl2 ![]() 2FeCl3 �� �ʴ�Ϊ��2Fe+3Cl2
2FeCl3 �� �ʴ�Ϊ��2Fe+3Cl2 ![]() 2FeCl3����4�������ܿڽ�С��Dװ���еĹ��������������ܿڣ��������ж����壬����ֱ���ſգ��������Ⱦ����������Ӧ����һ��β������װ�ã�
2FeCl3����4�������ܿڽ�С��Dװ���еĹ��������������ܿڣ��������ж����壬����ֱ���ſգ��������Ⱦ����������Ӧ����һ��β������װ�ã�
�ʴ�Ϊ�������ױ���Ʒ������β���������������ɻ�����Ⱦ����5����װ������β������װ�ã���β������װ������ˮ��Һ���ᵼ��E����ˮ�������ᵼ���Ȼ�����Ʒ�׳��⣬����Ϊ��ֹ�Ȼ������⣬��ƿE��F֮������װ�и������װ�ã�
�ʴ�Ϊ����Ʒ�׳��⣻��ƿE��F֮������װ�и������װ�ã�
��1��ʵ����������������Ӧ��ȡ�Ȼ�������������Ҫ��ȡ������һ�㳣��Ũ����Ͷ������̷�Ӧ��ȡ��������2���������ɵ������ų�װ���еĿ�������������3�����������£�����������Ӧ�����Ȼ�������4�������ױ���Ʒ�������ж�����Ӧ����β������װ�ã���5��β������װ������ˮ�������Ȼ����׳��⣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һ��ӦΪ��3Fe2++2S2O32-+O2+xOH-�TFe3O4+S4O62-+2H2O������˵���в���ȷ���ǣ�������
A. x=4
B. 1mol Fe2+������ʱ����Fe2+��ԭ��O2�����ʵ���Ϊ1/3 mol
C. Fe2+��S2O32-���ǻ�ԭ��
D. ÿ����1mol Fe3O4����Ӧת�Ƶ��ܵ�����Ϊ4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӵ�ֱ������ӽ���������һ����ֵ
A.1��10-8mB.1��10-8cmC.1��10-10mD.1��10-10cm
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�У�ˮֻ������������
A. 2Na+2H2O=2NaOH+H2��B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2D. CaO+H2O=Ca(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL0.50molL��1������50mL0.55molL��1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȣ��ش��������⣺ 
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��
��2����ʵ������У���ͬѧ��Ҫ�ⶨ����¼��ʵ��������������ţ���
A.�����Ũ��
B.������¶�
C.����������Һ��Ũ��
D.����������Һ���¶�
E.ˮ�ı�����
F.��Ӧ������Һ����ֹ�¶�
��3���кͷ�Ӧ������ʵ���¶�ƽ������3.4�森��֪�кͺ����ɵ���Һ�ı�����Ϊ4.18J/��g�棩���������Һ���ܶȾ�Ϊ1g/cm3 �� ͨ������ɵ��к��ȡ�H=
��4��ʵ���и���60mL0.50molL��1�����50mL0.55molL��1NaOH��Һ���з�Ӧ����������ȷ��ʵ�������ȣ����ų������������ȡ�����ȡ����������к��������ȡ�����ȡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3L���ܱ������з�ӦCO��g��+2H2��g��CH3OH��g���ﵽ��ѧƽ��״̬�� 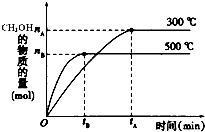
��1���÷�Ӧ��ƽ�ⳣ������ʽK=������ͼ�������¶ȣ�Kֵ������ѹǿKֵ�������������С�����䡱����
��2��500��ʱ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬��H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����������nA��nB��tA��tB��ʾ����
��3���жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��������ĸ����
a��v������CH3OH��=v������CO�� b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı� d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯
��4��300��ʱ�����������ݻ�ѹ����ԭ���� ![]() ���������������������£���ƽ����ϵ������Ӱ����������ĸ����
���������������������£���ƽ����ϵ������Ӱ����������ĸ����
a��c��H2������ b����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
c��CH3OH �����ʵ������� d������ƽ��ʱc��H2��/c��CH3OH����С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ҵ������Ĵ����ͷ��ξ�����Ҫ�����塣
(1)���÷�ӦCH4��2NO2![]() N2��CO2��2H2O������NO2����Ⱦ���÷�Ӧ����������________��������CH4�������11.2 L(��״����)ʱ�������Ͽɴ���________g NO2��
N2��CO2��2H2O������NO2����Ⱦ���÷�Ӧ����������________��������CH4�������11.2 L(��״����)ʱ�������Ͽɴ���________g NO2��
(2)��������β����CO��NO��һ�ַ����ǣ��������������а�װһ����ת��װ�ã���װ���ܽ�CO��NOת��Ϊ�������ѭ���������塣�÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(3)��һƿ��Һ�����п��ܺ���H����NH![]() ��K����Na����Mg2����Ba2����Fe3����SO
��K����Na����Mg2����Ba2����Fe3����SO![]() ��CO
��CO![]() ��Cl�D��I�D��ȡ����Һ��������ʵ�飺
��Cl�D��I�D��ȡ����Һ��������ʵ�飺
�� ��pH��ֽ���飬������Һ��ǿ���ԣ�
�� ȡ������Һ������������ˮ��2 mL CCl4������CCl4����Ϻ�ɫ��
�� ��ȡ������Һ������NaOH��Һʹ���Ϊ���ԣ��������ɣ�
�� ȡ��������������Һ����Na2CO3��Һ���а�ɫ�������ɣ�
�� ���۵õ��ļ�����Һ���ȣ�������ų�����������ʹʪ��ĺ�ɫʯ����ֽ������
��������ʵ����ʵ����֪����Һ�п϶����е�������______________���϶�û�е�������________________��������ȷ���Ƿ��е�������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʪ���KI������ֽ�Ӵ�ij���������ɫ���������п�����()
��Cl2��NO2��H2S��SO2��HCl��������
A.�٢ۢ�
B.�٢ڢ�
C.�٢ڢ�
D.�ڢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com