
����Ŀ���ѻӷ��Զ����㣨TaS2���ɲ�������װ���ᴿ����������TaS2��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�У���Ӧ���£�TaS2��s��+2I2��g��TaI4��g��+S2��g������˵����ȷ���ǣ� �� ![]()
A.�ڲ�ͬ�¶�����TaI4�������ֲ���
B.���ᴿ�����У�I2�������ϼ���
C.���ᴿ�����У�I2�������ǽ�TaS2�Ӹ�����ת�Ƶ�������
D.�÷�Ӧ��ƽ�ⳣ����TaI4��S2��Ũ�ȳ˻��ɷ���
���𰸡�C
���������⣺A�����ݷ�Ӧ������֪���¶Ȳ�ͬʱ��Ӧ���е���Ҫ����ͬ��TaI4�����ı䣬��A����B����Ϊ����ͬһ�ܱ�ϵͳ���������غ㶨�ɿ�֪I2���������ܲ��ϼ��٣���һ�������´ﵽƽ����ٱ仯����B����
C�����ᴿ�����У�I2�������dz䵱һ�������˹����Ľ�ɫ����TaS2�Ӹ�����ת�Ƶ��������Դﵽ�ᴿ��Ŀ�ģ���C��ȷ��
D������ƽ�ⳣ������ʽ��֪��ƽ�ⳣ����ƽ��ʱ�������Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ�ȵ��ݴη��˻�������ƽ�ⳣ��K��Tal4��S2��Ũ�ȳ˻������ȣ���D����
��ѡC��
Ӧ�������Ϣ�еĻ�ѧƽ�⣬���ƽ������ۺ�֪ʶ���з����жϣ�TaS2��s��+2I2��g��TaI4��g��+S2��g���ǻ�ѧƽ�⣬�����㣨TaS2�����ѻӷ������ʣ����ͼʾ�ж������λ�ÿ�֪���ᴿ�ǰѶ����㣨TaS2���͵ⵥ���ڸ����·�Ӧ��������TaI4��g����S2��g�������Ը÷�Ӧ����Ӧ�����ȷ�Ӧ����������ɢ����������ƽ���������ɶ����㣨TaS2����I2��g����ʹ�����㣨TaS2���õ��ᴿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ�ų�222.5kJ�������������Ȼ�ѧ����ʽ����ȷ���ǣ� ��
A.2CH4��g��+4O2��g���T2CO2��g��+4H2O��l����H=+890 kJmol��1
B.CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=+890 kJmol��1
C.CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890 kJmol��1
D.2CH4��g��+4O2��g���T2CO2��g��+4H2O��l����H=��890 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��֪��A��B��C��D����Ԫ�أ�ԭ��������������A�Ƕ�����Ԫ���н�������ǿ��Ԫ�أ�BԪ��3p�ܼ��������C���������ڵ縺������Ԫ�أ�D�ǵ�������δ�ɶԵ�������Ԫ�ء��Իش������й����⣺
��1��д��DԪ�ؼ۵��ӵĵ����Ų�ʽ��
��2��D���γɻ�����[D(H2O)6](NO3)3��
��[D(H2O)6](NO3)3�������ӵ����幹������NO3����ԭ�ӵĹ���ӻ�����Ϊ��
����[D(H2O)6]3+��D3+��H2O֮���γɵĻ�ѧ����Ϊ �� 1 mol [D(H2O)6] 3+�к��еĦҼ���mol��
��3����֪B��C����Ԫ���γɵĻ�����ͨ�������֡������ֻ�������(�ѧʽ)Ϊ�Ǽ��Է��ӡ���һ�����ʵĵ���ʽΪ��
��4����A��C��Ԫ���γɵĻ�������ɵľ����У����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С�������ͼ��ʾΪA��C�γɻ�����ľ����ṹͼ�Լ�����������ͼ��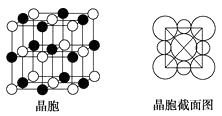
�����о���һ��A+�����C��������ЩCΧ�ɵ�ͼ�������������ܶ�Ϊ�� g��cm3 �� �����ӵ�������ֵ��NA��ʾ����A+�����Ӱ뾶Ϊcm(�ú�NA������ʽ�ӱ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.4.1gH3PO3����2gNaOH��ȫ��Ӧ�������Σ���H3PO3Ϊ__________Ԫ�ᡣ�����εĵ��뷽��ʽΪ_________________��
��С�մ�θ��ƽ����ϲ���dz��õ��к�θ���ҩ�
(1)С�մ�ƬÿƬ��0.504gNaHCO3��2ƬС�մ�Ƭ���к�θ���е�H+��_____mol��
(2)θ��ƽÿƬ��0.234gAl(OH)3���к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ__________��
(3)��ϲ�Ļ�ѧ�ɷ�������þ�ļ�ʽ̼���Ρ�ȡ�ü�ʽ�η�ĩ3.01g����μ���2.0mol/L����ʹ���ܽ�(�����ɷֲ������ᷴӦ)������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������˵����ȷ����
A.����������ɫ����B.����������ˮ����
C.��ʹ����ĺ�ɫ������ɫD.H2��Cl2��ȼ�գ�����ʵ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ������������������о���������Ҫ����;�����¿�ͼ�Ǵ����������Ʊ����Ĺ������̣�
��֪�������������Ҫ�ɷ���Al2O3 �� �����������SiO2��Fe2O3�����ʣ�����Һ�еĹ�������ƫ�����Ʒ�Ӧ�������ɹ������γ�������ѧ����ʽΪ��2Na2SiO3+2NaAlO2+4H2O�TNa2Al2Si2O8��+2H2O+4NaOH
�ش��������⣺
��1���ܽ�������ʱ��������Ӧ�����ӷ���ʽΪ�� ��
��2������A����Ҫ�ɷ������������γ���д�����������ʽ�� ��
��3���ڹ������̵������У�ѡ�ö�����̼���ữ������ʹ�������ԭ���� ��
��4�����ù�����mkg�������Ƶ�nkg Al������ÿ����Ӧ������ȫ��������������Al2O3����������Ϊ ��
��5���������ܽ⣬�����Լ������ѡ�������ţ���
A.Ũ����
B.ϡ����
C.ϡHNO3
D.ŨHNO3
��6�����ұ����ʱ��Na3AlF6�����ۼ���Na3AlF6�����������ڽ��� �� ��λ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. Cl2��2KBr=Br2��2KCl
B. 2NH4Cl + Ca(OH )2![]() CaCl2 +2NH3��+ 2H2O
CaCl2 +2NH3��+ 2H2O
C. 3Mg��N2![]() Mg3N2
Mg3N2
D. 2Na2O2��2CO2=2Na2CO3��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�ǻ����B�ǽ������ʣ�����֮�����Ӧ�Լ�������֮���ת����ϵ��ͼ��ʾ��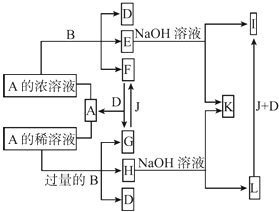
��1������B��Ԫ�����ڱ��е�λ���� �� B��A��Ũ��Һ��Ӧ�������� �� д������B��A��ϡ��Һ��Ӧ�����ӷ���ʽ�� ��
��2��������0.1 mol/L E��ˮ��Һ�и�����Ũ�ȴ�С��ϵΪ ��
��3��Lת��ΪI�������� �� д���йصĻ�ѧ����ʽ�� ��
��4����μ��H��Һ�������ӵĴ��ڣ�д��ʵ����������������ۣ� ��
��5����֪25��ʱFe��OH��3��Ksp=3.5��10��39 �� �ֽ�4.0��10��8 mol/L E��Һ��2.0��10��8 mol/L NaOH��Һ�������ϣ�������Һ���ʱ����ı仯����ͨ����ʽ����˵���Ƿ��г��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ�г������ʵ�ת����ϵͼ�У���Ӧ���������ַ�Ӧ��Ͳ���δȫ��ע������֪A��DΪ�������ʣ�����Ϊ�������B�Ǻ�ɫ���ʣ���һ�ֿ�ʯ����Ҫ�ɷ֣�
���ƶϣ�
��1��A��ԭ�ӽṹʾ��ͼΪ �� д��B�Ļ�ѧʽ�� �� д��C�Ļ�ѧʽ�� �� ��Ҫ�ɷ���J�Ŀ�ʯ�����ƣ� ��
��2���ڷ�ӦF��E�У�ҪʹF�е�һ�ֽ���Ԫ��ȫ���Գ�������ʽ�����������˼���ķ�Ӧ���� �� Dͨ�����Ϸ�Ӧת��ΪGӦ����ķ�Ӧ��Ϊ �� F��E����Һ��Ϻ�������� ��
��3��д�����з�Ӧ�ķ���ʽ��H��I�Ļ�ѧ����ʽ �� C��F�����ӷ���ʽ �� F��E�����ӷ���ʽ ��
��4������G��Һ�����������ӵķ����� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com