
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3 , 此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为、 .
(2)滤渣A的主要成分是;硅铝酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝溶解,下列试剂中最好选用(填编号).
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 , 配位数为 .
【答案】
(1)2OH﹣+Al2O3═2AlO2﹣+H2O;SiO2+2OH﹣═SiO32﹣+H2O
(2)Fe2O3、Na2Al2SiO8;Na2O?Al2O3 . ?2SiO2
(3)盐酸是强酸,Al(OH)3溶于强酸而不溶于弱酸,通入二氧化碳是为了提高Al2O3的提取率
(4)5100n/27m%或 1700n/9m%
(5)B
(6)[AlF6]3﹣;6
【解析】解:(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水.所以答案是:2OH﹣+Al2O3═2AlO2﹣+H2O;SiO2+2OH﹣═SiO32﹣+H2O(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2 ,
而铝土矿的主要成分是Al2O3 , SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,
滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8 , 滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式是:金属氧化物非金属氧化物水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同,
写成Na2OAl2O3 . 2SiO2 .
所以答案是 Fe2O3、Na2Al2Si2O8 Na2OAl2O3 . 2SiO2(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,
强酸过量后Al(OH)3会溶解.
所以答案是:盐酸是强酸,Al(OH)3溶于强酸而不溶于弱酸,通入二氧化碳是为了提高Al2O3的提取率.(4)已知铝nkg,可算出铝的物质的量,n(Al)= ![]() mol,根据原子守恒:2Al~Al2O3 , 三氧化二铝的物质的量n(Al2O3)=
mol,根据原子守恒:2Al~Al2O3 , 三氧化二铝的物质的量n(Al2O3)= ![]() n(Al),
n(Al),
n(Al2O3)= ![]() ,所以Al2O3的质量为
,所以Al2O3的质量为
m=n(Al2O3)M(Al2O3)= ![]() mol×102 gmol﹣1 =
mol×102 gmol﹣1 = ![]() g,所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量,即
g,所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量,即 ![]() ÷1000m=
÷1000m= ![]() ;质量分数一般要乘以100%.
;质量分数一般要乘以100%.
所以答案是: ![]() % 或
% 或 ![]() %. (5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体,且等量的铝溶解消耗稀硝酸更多,消耗稀硫酸更少,从环保、节约的角度考虑,应用稀硫酸溶解铝.
%. (5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体,且等量的铝溶解消耗稀硝酸更多,消耗稀硫酸更少,从环保、节约的角度考虑,应用稀硫酸溶解铝.
故选B.(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个.
所以答案是:[AlF6]3﹣;6.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 78g Na2O2固体中阴离子的个数为2NA
B. 标准状况下,1.12L氯气与H2O反应,反应中转移的电子数为0.1NA
C. 60g SiO2含有的化学键数目为4NA
D. CO2通过Na2O2使其增重ag时,反应中转移的电子数为aNA/56
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)=1xl0﹣13 mol/L的溶液中:K+、Na+、SiO ![]() 、SO
、SO ![]()
B.1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO ![]() 、Cl﹣
、Cl﹣
C.在c(OH﹣):c(H+)=1×1012的溶液:NH ![]() 、Ca2+、C1﹣、K+
、Ca2+、C1﹣、K+
D.甲基橙显黄色的溶液:Na+、CO ![]() 、NO
、NO ![]() 、SO
、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
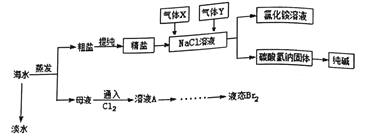
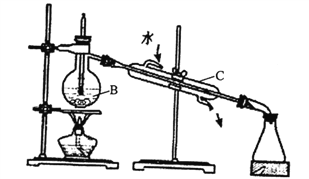
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B____________、C_________;B装置中如果忘加沸石,应_________;下图装置中有___________处错误。
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器是__________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
a、溶解;b、依次加入过量的_________溶液、NaOH 溶液、c、_________;d、加适量盐酸; e、___________ (请补全缺少的试剂和实验步骤)。
(4)实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时:
①需要用托盘天平称量氯化钠的质量____________ g。
②下列实验操作会使配制结果偏高的是_______。
A.砝码生锈了 B.定容时俯视刻度线
C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水
E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切
(5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为_________、____________,你认为先通气体X的原因是_______________,该反应的化学方程式为__________________。
(6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( ) ![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: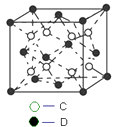
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 .
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(3)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(4)A的单质中δ键的个数为 , π键的个数为 .
(5)写出基态E原子的价电子排布式: .
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ gcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.40mL
B.45mL
C.50mL
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法中错误的是
A. 1 mol H2含有的原子数为2NA
B. NA个水分子中含有氢原子的物质的量为2 mol
C. 1 mol O2中含有的分子数为2NA
D. 0.25 mol H2SO4含有NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
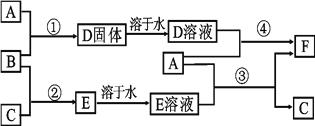
请回答:
(1)写出B物质的化学式:____;F的化学名称:____。
(2)写出第②步C在B中燃烧的反应现象:____。
(3)写出第④步反应的化学反应方程式____。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com