
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 78g Na2O2固体中阴离子的个数为2NA
B. 标准状况下,1.12L氯气与H2O反应,反应中转移的电子数为0.1NA
C. 60g SiO2含有的化学键数目为4NA
D. CO2通过Na2O2使其增重ag时,反应中转移的电子数为aNA/56
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________________。
(2)H2O2分解的化学方程式为________________________。
(3)实验①和②的目的是_______________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
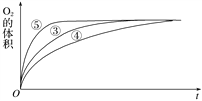
分析上图能够得出的实验结论是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯的分子式可写成(CH2)2
B. 乙烯的最简式为CH—CH
C. 乙烯分子是空间平面结构
D. 乙烯的结构简式为CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为: . 反应开始至2min,Z的平均反应速率为 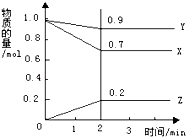
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1min后,测得容器内A的浓度为x molL﹣1 , 这时B的浓度为 molL﹣1 , C的浓度为 molL﹣1 . 这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为________,物质的量之比为________,原子总数之比为________, 密度之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙烯分子结构的说法中,错误的是
A. 乙烯分子里含有碳碳双键
B. 乙烯分子里所有的原子共平面
C. 乙烯分子中碳碳双键和乙烷分子中碳碳单键相同
D. 乙烯分子里共价键之间的夹角为120°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。
Ⅰ.CO可用于合成甲醇
(1)已知CO、H2、CH3OH(g)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-764.5kJ/mol,则CO(g)+2H2(g)![]() CH3OH(g)的△H=________。
CH3OH(g)的△H=________。
(2)将lmolCO和2molH2充入密闭容器中发生上述反应。其他条件相同时.CO的平衡转化率与压强(P)和温度(T)的关系如图所示。
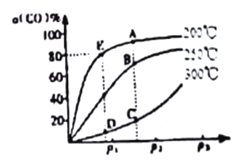
① A、B两点CH3OH的质量分数ω(A)_____ω(B )(填“>”、“<”或“=”)。
② C、D两点的逆反应速率:v(C)_____v(D)(同上)。
③ 200℃ 时,测得E点的容器容积为10L。该温度下,反应的平街常数K=_______;保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ. CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为lL的恒容密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使
CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使![]() 增大的是______(填选项字母)。
增大的是______(填选项字母)。
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂 D.再充入一定量H2O
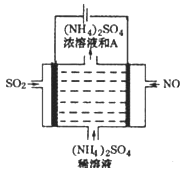
Ⅲ.(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____,阴极的电极反应式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com