
【题目】关于乙烯分子结构的说法中,错误的是
A. 乙烯分子里含有碳碳双键
B. 乙烯分子里所有的原子共平面
C. 乙烯分子中碳碳双键和乙烷分子中碳碳单键相同
D. 乙烯分子里共价键之间的夹角为120°
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】为清理路面积雪人们常使用一种融雪剂,其主要成分的化学式为XY2 , X,Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子.
该融雪剂的化学式是 , 该物质中化学键类型是 , 电子式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 78g Na2O2固体中阴离子的个数为2NA
B. 标准状况下,1.12L氯气与H2O反应,反应中转移的电子数为0.1NA
C. 60g SiO2含有的化学键数目为4NA
D. CO2通过Na2O2使其增重ag时,反应中转移的电子数为aNA/56
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法中正确的是(填序号).
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中H+的浓度均减小
②在相同时间内,两烧杯中产生气泡的速率:甲乙(填“>”、“<”或“=”).
③甲中硫酸根离子向极移动(填“铜”或“锌”)
④当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为 .
(2)欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为 , 电解质溶液为 , 正极反应为 , 10min内该电池向外提供0.1mol电子,则正极材料与负极材料的质量差为g(假设刚开始时,两电极的质量相等).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片和稀硫酸反应制取H2时,下列措施不能使氢气的生成速率增大的是( )。
A.加热
B.不用稀硫酸,而改用98%的浓硫酸
C.滴加少量浓盐酸
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
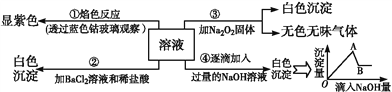
请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明:在其它条件相同时,对反应速率有影响.
(2)我们最好选取实验(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的 , 反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com