
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
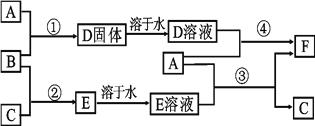
请回答:
(1)写出B物质的化学式:____;F的化学名称:____。
(2)写出第②步C在B中燃烧的反应现象:____。
(3)写出第④步反应的化学反应方程式____。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____。
【答案】 Cl2 氯化亚铁 产生苍白色火焰,瓶口有白雾产生 Fe+2FeCl 3=3FeCl2 先产生白色沉淀,后立即变成灰绿色,最后变成红褐色
【解析】A是用途最广的金属,A铁。B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,说明D中含有铁离子,所以B是氯气,D是氯化铁,氯化铁与铁反应生成氯化亚铁,即F是氯化亚铁。铁和E溶液反应生成C和氯化亚铁,则E是盐酸,C是氢气,E是氯化氢。
(1)B是氯气,化学式为Cl2;F是氯化亚铁。(2)氢气在氯气中燃烧的反应现象为产生苍白色火焰,瓶口有白雾产生。(3)第④步反应的化学反应方程式为Fe+2FeCl3=3FeCl2。(4)F溶液中滴入NaOH溶液可能产生的实验现象是先产生白色沉淀,后立即变成灰绿色,最后变成红褐色。


科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3 , 此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为、 .
(2)滤渣A的主要成分是;硅铝酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝溶解,下列试剂中最好选用(填编号).
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 , 配位数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】7.2 g H2O所含有的质子数与多少克H2SO4所含的氧原子数相等,它们所含氧原子数之比是多少,氢原子数之比是多少。(要计算过程)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明.已知A、D为金属单质,其他为化合物.(B是黑色物质,是一种矿石的主要成分)
试推断:
(1)A的原子结构示意图为 , 写出B的化学式: , 写出C的化学式: , 主要成分是J的矿石的名称: .
(2)在反应F→E中,要使F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是 , D通过化合反应转化为G应加入的反应物为 , F和E两溶液混合后的现象是 .
(3)写出下列反应的方程式:H→I的化学方程式 , C→F的离子方程式 , F→E的离子方程式 ,
(4)鉴定G溶液中所含阳离子的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( ) 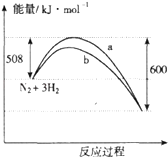
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJmol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下: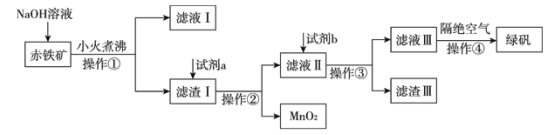
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为___________________________;
________________________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为__________________________;________________________________;
___________________________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,且D与E原子的最外层电子数之比为2:1,C与E能形成离子化合物EC.
(1)D元素的原子结构示意图为;
(2)B元素的名称为;
(3)用电子式表示A2C的形成过程;
(4)写出E的碳酸氢盐与足量KOH溶液反应的离子方程式:;
(5)写出EA2与水反应放出气体的化学方程式,并用单线桥表示电子转移方向和数目 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com