
【题目】周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,且D与E原子的最外层电子数之比为2:1,C与E能形成离子化合物EC.
(1)D元素的原子结构示意图为;
(2)B元素的名称为;
(3)用电子式表示A2C的形成过程;
(4)写出E的碳酸氢盐与足量KOH溶液反应的离子方程式:;
(5)写出EA2与水反应放出气体的化学方程式,并用单线桥表示电子转移方向和数目 .
【答案】
(1)![]()
(2)氟
(3)![]()
(4)Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O
(5)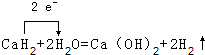
【解析】解:周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,D和E不能同时是第三周期的元素,否则A和C都是氢,结合原子半径知E是第四周期的元素中的钾或钙,D是第三周期的元素,A是氢,则E是钙(钾与氢同主族),D与E原子的最外层电子数之比为2:1,则D是硅,结合“C与E能形成离子化合物EC”知C是氧,根据原子半径知B是氟.(1)D为Si元素,原子结构示意图为 ![]() ,故答案为:
,故答案为: ![]() ;(2)B元素的名称为氟,故答案为:氟;(3)用电子式表示H2O的形成过程:
;(2)B元素的名称为氟,故答案为:氟;(3)用电子式表示H2O的形成过程: ![]() ,故答案为:
,故答案为: ![]() ;(4)E的碳酸氢盐与足量KOH溶液反应的离子方程式:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O;(5)CaH2与水反应放出气体,反应化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑,并用单线桥表示电子转移方向和数目为:
;(4)E的碳酸氢盐与足量KOH溶液反应的离子方程式:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O;(5)CaH2与水反应放出气体,反应化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑,并用单线桥表示电子转移方向和数目为: 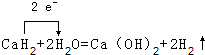 , 故答案为:
, 故答案为: 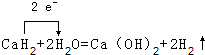 .
.
周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,D和E不能同时是第三周期的元素,否则A和C都是氢,结合原子半径知E是第四周期的元素中的钾或钙,D是第三周期的元素,A是氢,则E是钙(钾与氢同主族),D与E原子的最外层电子数之比为2:1,则D是硅,结合“C与E能形成离子化合物EC”知C是氧,根据原子半径知B是氟.


科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
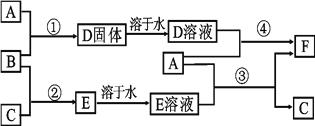
请回答:
(1)写出B物质的化学式:____;F的化学名称:____。
(2)写出第②步C在B中燃烧的反应现象:____。
(3)写出第④步反应的化学反应方程式____。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
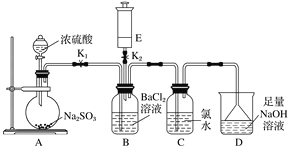
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________。
(2)写出C中反应的化学方程式:_______________________________________。
(3)D的作用是___________________________________________________,
反应的离子方程式为_______________________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________,
反应的离子方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4 .
①Mn2+基态的电子排布式可表示为 .
②NO3﹣的空间构型是(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2 , HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为 .
②H2O 分子中O 原子轨道的杂化类型为 .
③1mol CO2 中含有的σ键数目为 .
(3)向CuSO4 溶液中加入过量NaOH 溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]. 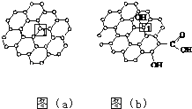
(1)图(a)中,1号C与相邻C形成σ键的个数为 .
(2)图(b)中,1号C的杂化方式是 , 该C与相邻C形成的键角(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角.
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类:

(1)上图所示的物质分类方法名称是________。
(2)以H、O、N、S中两种或三种元素组成合适的物质,分别填在下表②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ②____ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O2 |
(3)过量⑦通入④中反应的离子方程式:______________________________。
(4)设阿伏加德罗常数的值为NA。15.9g ⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为_______________。
(5)上述八种物质中有两种可发生离子反应:NH4++OH-![]() NH3·H2O,其对应的化学反应方程式为____________________________________________________。
NH3·H2O,其对应的化学反应方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B物质的浓度减少了0.2molL﹣1 . 下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02molL﹣1min﹣1
B.在5min时,容器内D的浓度为0.2molL﹣1
C.该反应随着反应的进行,容器内压强逐渐增大
D.5min时容器内气体总的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
A、B、C、D,E均由Q,R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 , R、X、T的原子半径从小到大的顺序为(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显性,其原因用离子方程式表示为;
(3)A和X2反应的化学方程式为;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH﹣)之比为;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一结晶水合物x6H2O,可发生如下的转化(部分反应物生成物已略).其中B、D、F均为无色气体,G为难于水的红褐色固体,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.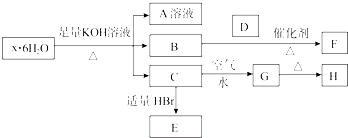
(1)该结晶水合物的化学式为 .
(2)把C溶于过量的稀H2SO4 , 再加KMnO4溶液,所涉及的离子方程式: .
(3)向E溶液中通入等物质的量的Cl2 , 写出反应的离子方程式: .
(4)C→G的现象为 , 该反应的化学方程式为 .
(5)向一定量的Cu与H的混合物中加入300 mL 1 mol/L HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后无红色出现.若用过量的CO在高温下还原相同质量的此混合物,固体的质量减小g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com