
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
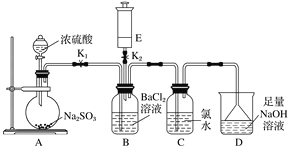
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________。
(2)写出C中反应的化学方程式:_______________________________________。
(3)D的作用是___________________________________________________,
反应的离子方程式为_______________________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________,
反应的离子方程式为_______________________________________________。
【答案】 有气泡产生 SO2+Cl2+2H2O===H2SO4+2HCl 吸收多余SO2,防止污染空气 SO2+2OH-===SO![]() +H2O 产生白色沉淀 Ba2++2NH3+H2SO3===BaSO3↓+2NH
+H2O 产生白色沉淀 Ba2++2NH3+H2SO3===BaSO3↓+2NH![]()
【解析】E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝,此气体为NH3;
(1)实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸,A中有SO2气体生成,因H2SO3的酸性比HCl酸性弱,SO2通入BaCl2的溶液不中无沉淀生成,只有气泡产生;
(2)SO2通入氯水中发生氧化还原反应,氯水的浅绿色褪去,发生反应的化学方程式为SO2+Cl2+2H2O===H2SO4+2HCl;
(3)SO2是酸性氧化物,且对环境有污染,利用D中足量NaOH溶液可达到吸收多余SO2,防止污染空气,发生反应的离子方程式为SO2+2OH-=SO![]() +H2O;
+H2O;
(4)A中反应完成后,关闭K1,打开K2,将E中的NH3注入B中,观察到B中现象是产生白色沉淀,发生反应的离子方程式为Ba2++2NH3+H2SO3===BaSO3↓+2NH![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】7.2 g H2O所含有的质子数与多少克H2SO4所含的氧原子数相等,它们所含氧原子数之比是多少,氢原子数之比是多少。(要计算过程)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( ) 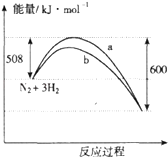
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJmol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下: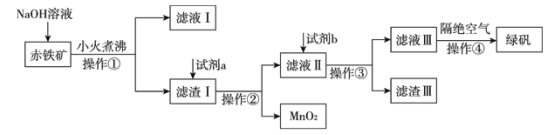
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为___________________________;
________________________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为__________________________;________________________________;
___________________________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4B. 盐酸
C. NaOHD. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 107 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是( )
A. 蒸馏法B. 升华法C. 萃取法D. 过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,且D与E原子的最外层电子数之比为2:1,C与E能形成离子化合物EC.
(1)D元素的原子结构示意图为;
(2)B元素的名称为;
(3)用电子式表示A2C的形成过程;
(4)写出E的碳酸氢盐与足量KOH溶液反应的离子方程式:;
(5)写出EA2与水反应放出气体的化学方程式,并用单线桥表示电子转移方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。

试解答下列各题:
(1)写出下列物质的化学式:X________,B________,G__________
(2)写出下列反应的化学方程式:
C+D![]() E:___________________________________________
E:___________________________________________
(3)写出下列反应的离子方程式:
G+Cu![]() E:___________________________________________
E:___________________________________________
(4)工业上合成C,合成后采用加压降温液化方法从混合气体中分离出C,能用上述方法分离出C的原因是______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com