
【题目】如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( ) 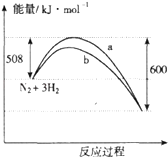
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJmol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
【答案】C
【解析】解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g),△H=﹣92kJmol﹣1 , 故A错误;B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,所以该化学反应的反应热不变,故C正确;
D、在相同温度的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ,如果平衡不移动,则Q2=2Q1 , 但是增大反应物物质的量器压强增大,平衡正移,所以放出的热量增多,Q2>2Q1 , 故D错误;
故选:C.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.40mL
B.45mL
C.50mL
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的部分实验方案如下:
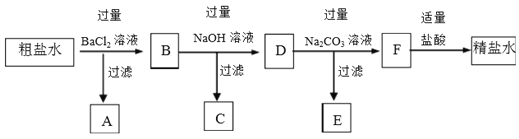
(1)粗盐水中含有的阳离子有_______,阴离子有__________。
(2)加入BaCl2溶液的目的是(用离子方程式表示)_________。
(3)生成沉淀C的离子方程式是______。
(4)D中所含离子有_______。
(5)E的主要成分的化学式是____。
(6)用文字描述加入适量盐酸的目的是________。
(7)某同学认为加入过量K2CO3溶液与加入过量Na2CO3溶液同样可以达到实验目的,这种说法是否合理,请说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
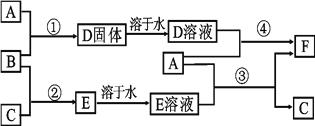
请回答:
(1)写出B物质的化学式:____;F的化学名称:____。
(2)写出第②步C在B中燃烧的反应现象:____。
(3)写出第④步反应的化学反应方程式____。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+ ![]() C(s)═
C(s)═ ![]() CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+ ![]() O2(g)═Fe2O3(s)的△H是( )
O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4 kJ/mol
B.﹣627.6 kJ/mol
C.﹣744.7 kJ/mol
D.﹣169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,把气体缓慢通入盛有足量试剂的试剂瓶A和试管B,在试管B中不能观察到明显现象的是( )
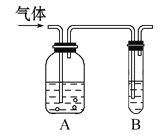
选项 | 气体 | A中试剂 | B中试剂 |
A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
B | Cl2、HCl | 饱和NaCl溶液 | KI淀粉溶液 |
C | CO2、HCl | 饱和NaHCO3溶液 | NaAlO2溶液 |
D | NH3、CO2 | 浓硫酸 | 酚酞试液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 请回答下列问题: 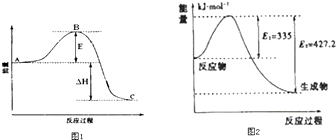
①图中△H=KJmol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充入2mol N2和6mol H2 , 达平衡后放出的热量为Q2 kJ,则Q22Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
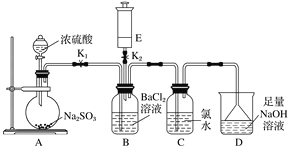
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________。
(2)写出C中反应的化学方程式:_______________________________________。
(3)D的作用是___________________________________________________,
反应的离子方程式为_______________________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________,
反应的离子方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B物质的浓度减少了0.2molL﹣1 . 下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02molL﹣1min﹣1
B.在5min时,容器内D的浓度为0.2molL﹣1
C.该反应随着反应的进行,容器内压强逐渐增大
D.5min时容器内气体总的物质的量为3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com