
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 请回答下列问题: 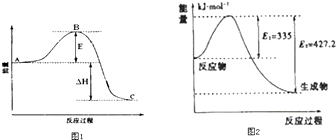
①图中△H=KJmol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充入2mol N2和6mol H2 , 达平衡后放出的热量为Q2 kJ,则Q22Q1(填“>”、“<”或“=”)
【答案】
(1)CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
(2)432kJ/mol
(3)﹣198;降低
(4)46.1kJ;18.44;>
【解析】解:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;所以答案是:CH3OH(l)+
O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;所以答案是:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
△H=反应物键能总和﹣生成物键能总和得到:﹣185kJ/mol=436KJ/mol+243KJ/mol﹣2E(H﹣Cl)
则E(H﹣Cl)=432kJ/mol;
所以答案是:432kJ/mol;(3)①因1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 , 所以2molSO2(g)氧化为2molSO3的△H=﹣198kJmol﹣1 ,
则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJmol﹣1 , 所以答案是:﹣198;
②因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,加入催化剂,活化能减小,
所以答案是:降低;(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
所以答案是:46.1 kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,
N2(g)+ | 3H2(g) | = | 2NH3(g) | △H=﹣92.2KJ/mol |
1 | 3 | 0 | ||
0.2 | 0.6 | 0.4 |
生成0.4mol氨气放热= ![]() ×92,2KJ=18.44KJ;
×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol N2和6mol H2 , 可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
所以答案是:18.44,>.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: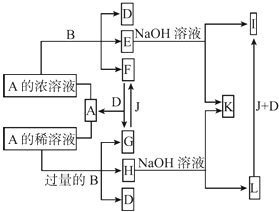
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明.已知A、D为金属单质,其他为化合物.(B是黑色物质,是一种矿石的主要成分)
试推断:
(1)A的原子结构示意图为 , 写出B的化学式: , 写出C的化学式: , 主要成分是J的矿石的名称: .
(2)在反应F→E中,要使F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是 , D通过化合反应转化为G应加入的反应物为 , F和E两溶液混合后的现象是 .
(3)写出下列反应的方程式:H→I的化学方程式 , C→F的离子方程式 , F→E的离子方程式 ,
(4)鉴定G溶液中所含阳离子的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( ) 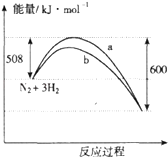
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJmol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是
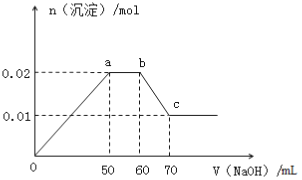
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1:1:2
C. 所加NaOH溶液物质的量浓度为1mol/L
D. a点到b点,NH4++OH- =NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下: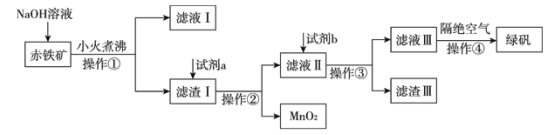
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为___________________________;
________________________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为__________________________;________________________________;
___________________________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4B. 盐酸
C. NaOHD. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C. 蒸发结晶时,应将溶液蒸干
D. 称量时,应将称量物放在托盘天平的左盘,砝码放在托盘天平的右盘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com