
【题目】有一结晶水合物x6H2O,可发生如下的转化(部分反应物生成物已略).其中B、D、F均为无色气体,G为难于水的红褐色固体,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.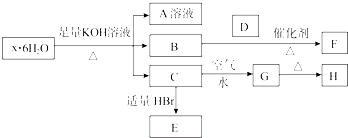
(1)该结晶水合物的化学式为 .
(2)把C溶于过量的稀H2SO4 , 再加KMnO4溶液,所涉及的离子方程式: .
(3)向E溶液中通入等物质的量的Cl2 , 写出反应的离子方程式: .
(4)C→G的现象为 , 该反应的化学方程式为 .
(5)向一定量的Cu与H的混合物中加入300 mL 1 mol/L HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后无红色出现.若用过量的CO在高温下还原相同质量的此混合物,固体的质量减小g.
【答案】
(1)(NH4)2Fe(SO4)2?6H2O
(2)Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O
(3)2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣
(4)白色沉淀迅速变成灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3
(5)2.4
【解析】解:结晶水合物中加入KOH溶液生成气体B,则B一定为NH3 , 结晶水合物中含有NH4+ , G为红褐色固体难溶物,说明其为Fe(OH)3 , 则C为Fe(OH)2 , 并说明结晶水合物中含Fe2+;A中加BaCl2溶液生成不溶于稀盐酸的白色沉淀,说明结晶水合物中含有SO42﹣ , 综上所述,结晶水合物为(NH4)2Fe(SO4)26H2O,则H为Fe2O3 , E为FeBr2 . (1)该结晶水合物的化学式为:(NH4)2Fe(SO4)26H2O,所以答案是:(NH4)2Fe(SO4)26H2O;(2)把Fe(OH)2溶于过量的稀H2SO4 , 再加KMnO4溶液,所涉及的离子方程式:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O,所以答案是:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O;(3)Fe2+的还原性大于Br﹣ , 通入等物质的量Cl2 , 不足以将其全部氧化,先氧化Fe2+ , 再氧化Br﹣ , 反应的离子方程式:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ , 所以答案是:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣;(4)Fe(OH)2变为Fe(OH)3的现象为白色沉淀迅速变成灰绿色,最后变为红褐色,该反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 , 所以答案是:白色沉淀迅速变成灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3;(5)H为Fe2O3 , 加入盐酸后发生反应依次为①Fe2O3+6HCl═2FeCl3+3H2O,②2FeCl3+Cu═CuCl2+2FeCl2 . 化合物恰好完全溶解,加入KSCN溶液后无红色出现,说明所得溶液溶质为CuCl2和FeCl2 , 原混合物中所含氧元素全部生成水,若用CO还原相同质量的混合物,其质量减少量为氧元素的质量,由题意,HCl的物质的量为0.3mol,结合方程式①,可得所含化合物中所含氧的物质的量等于生成水的物质的量,为0.15mol,其质量为0.15mol×16g/mol=2.4g,固体质量减少2.4g,所以答案是:2.4.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,且D与E原子的最外层电子数之比为2:1,C与E能形成离子化合物EC.
(1)D元素的原子结构示意图为;
(2)B元素的名称为;
(3)用电子式表示A2C的形成过程;
(4)写出E的碳酸氢盐与足量KOH溶液反应的离子方程式:;
(5)写出EA2与水反应放出气体的化学方程式,并用单线桥表示电子转移方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。

试解答下列各题:
(1)写出下列物质的化学式:X________,B________,G__________
(2)写出下列反应的化学方程式:
C+D![]() E:___________________________________________
E:___________________________________________
(3)写出下列反应的离子方程式:
G+Cu![]() E:___________________________________________
E:___________________________________________
(4)工业上合成C,合成后采用加压降温液化方法从混合气体中分离出C,能用上述方法分离出C的原因是______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作或事故处理方法正确的是( )
A. 为了节约,应将实验过程中取用的剩余药品放回原试剂瓶
B. 涉及气体实验的装置,在实验之前应先进行气密性检查
C. 酒精灯着火时可用水扑灭
D. 配制硫酸溶液时,先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐溶液中存在Ca2+、Mg2+、SO42-等杂质,除杂时加入NaOH、Na2CO3、BaCl2和盐酸,下列添加试剂顺序正确的有
①NaOH BaCl2Na2CO3HCl ②BaCl2HCl NaOH Na2CO3
③Na2CO3BaCl2NaOH HCl ④BaCl2 NaOH Na2CO3HCl
A. ①③B. ①④C. ③④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用BaSO4沉淀重量法测定样品中SO42-的含量时,发现滤液中有少许沉淀,检查滤纸并未破裂,此时他应该( )
A.将滤液倒回漏斗重新过滤
B.在漏斗中再加一张滤纸,将滤液重新过滤
C.另取一漏斗,将滤液过滤后与原滤纸合并
D.弃去,重新取样分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用![]() 表示原子:
表示原子:
(1)中性原子的中子数:N=______。
(2)阴离子的中子数:AXn-共有x个电子,则N=______。
(3)中性分子中子数:12C16O2分子中,N=______。
(4)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为____ mol。
Ⅱ.有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④![]() 、
、![]() 、
、![]() 四组微粒或物质,回答下列问题:
四组微粒或物质,回答下列问题:
(1)互为同位素的是________(填编号,下同)。
(2)互为同素异形体的是________。
(3)有①和④的微粒可组成______种相对分子质量不同的三原子化合物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装标签上印上警示性标志。下列的化学药品名称与警示标志名称对应不正确的是: ( )
A. 酒精——易燃品B. 浓硫酸——腐蚀品
C. 烧碱——剧毒品D. 氯酸钾——强氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com