
【题目】综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
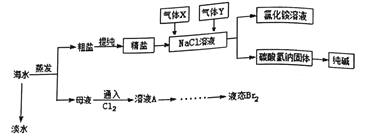
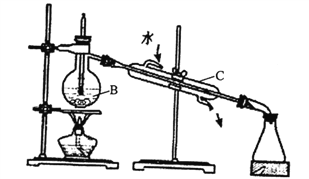
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B____________、C_________;B装置中如果忘加沸石,应_________;下图装置中有___________处错误。
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器是__________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
a、溶解;b、依次加入过量的_________溶液、NaOH 溶液、c、_________;d、加适量盐酸; e、___________ (请补全缺少的试剂和实验步骤)。
(4)实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时:
①需要用托盘天平称量氯化钠的质量____________ g。
②下列实验操作会使配制结果偏高的是_______。
A.砝码生锈了 B.定容时俯视刻度线
C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水
E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切
(5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为_________、____________,你认为先通气体X的原因是_______________,该反应的化学方程式为__________________。
(6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操作为_________。
【答案】 蒸馏烧瓶 冷凝管 停止加热,液体冷却后再加 3 分液漏斗 氯化钡溶液、碳酸钠溶液 过滤 蒸发 2.9 AB NH3 CO2 氨气溶解度大,易形成高浓度的碳酸氢根,便于生成的碳酸氢钠析出 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 取适量固体溶于水,向其中加入过量的硝酸,再加硝酸银,有白色沉淀生成,说明有氯化钠
【解析】(1)根据仪器构造可判断B、C仪器的名称分别是蒸馏烧瓶、冷凝管;B装置中如果忘加沸石,应先停止加热,液体冷却后再加;根据装置图可知温度计水银球没有放在蒸馏烧瓶的支管出口处、没有垫石棉网加热、冷却水没有下口进,上口出,共计是3处错误。(2)在母液中通入氯气可置换出单质溴,从溶液A中提取Br2的操作是萃取后分液,需要的主要仪器是分液漏斗。(3)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。所以操作如下:a、溶解;b、依次加入过量的氯化钡溶液、碳酸钠溶液、NaOH溶液、c、过滤;d、加适量盐酸;e、蒸发。(4)①配制时需要500mL容量瓶,所以需要用托盘天平称量氯化钠的质量为0.5L×0.1mol/L×58.5g/mol≈2.9g。②A.砝码生锈了氯化钠的质量增加,浓度偏高;B.定容时俯视刻度线,溶液体积减少,浓度偏高;C.没洗涤烧杯和玻璃棒,溶质减少,浓度偏低;D.容量瓶中残留少量蒸馏水无影响;E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切,溶液体积增加,浓度偏低,答案选AB;(5)要产生碳酸氢钠固体和氯化铵溶液,需要通入氨气和二氧化碳,由于氨气溶解度大,易形成高浓度的碳酸氢根,便于生成的碳酸氢钠析出,所以首先通入的是氨气,该反应的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。(6)检验该Na2CO3中少量的NaCl时只需要检验氯离子即可,所以实验操作为取适量固体溶于水,向其中加入过量的硝酸,再加硝酸银,有白色沉淀生成,说明有氯化钠。


科目:高中化学 来源: 题型:
【题目】(多选)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是( )
组别 | c(HCl)(mol/L) | 温度(℃) | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 块状 |
4 | 2.5 | 30 | 粉末状 |
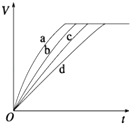
A.4﹣3﹣2﹣1
B.1﹣2﹣3﹣4
C.3﹣4﹣2﹣1
D.1﹣2﹣4﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A. Na2CO3、AgNO3、HNO3B. AgNO3、Na2CO3、HCl
C. AgNO3、Na2CO3、HNO3D. AgNO3、K2CO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.4.1gH3PO3可与2gNaOH完全反应生成正盐,则H3PO3为__________元酸。该正盐的电离方程式为_________________。
Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3,2片小苏打片能中和胃酸中的H+是_____mol。
(2)胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平__________。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体, C 是一种强酸。

请填写下列空白:
(1)写出下列物质的化学式:A:___________ E:_____________。
(2)写出反应④的离子方程式:______________________。
写出反应⑦的化学方程式:______________________。
写出反应⑩的化学方程式:______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号) 。
(4)写出检验M溶液中阳离子的方法:______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目:___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3 , 此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为、 .
(2)滤渣A的主要成分是;硅铝酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝溶解,下列试剂中最好选用(填编号).
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 , 配位数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com