
【题目】下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体, C 是一种强酸。

请填写下列空白:
(1)写出下列物质的化学式:A:___________ E:_____________。
(2)写出反应④的离子方程式:______________________。
写出反应⑦的化学方程式:______________________。
写出反应⑩的化学方程式:______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号) 。
(4)写出检验M溶液中阳离子的方法:______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目:___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:__________________。
【答案】 SO2 Fe(OH)3 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 2Al+Fe2O3![]() 2Fe+Al2O3 3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O ②⑧ 加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+(其他合理答案也可)
2Fe+Al2O3 3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O ②⑧ 加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+(其他合理答案也可) 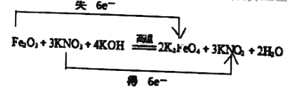 Cl2+2NaClO2=2ClO2+2NaCl
Cl2+2NaClO2=2ClO2+2NaCl
【解析】I是由地壳中含量最多的金属元素组成的单质,I是铝。K是一种红棕色气体,K是二氧化氮,所以L是NO,J是硝酸溶液。由反应4FeS2+11O2![]() 2Fe2O3+8SO2可知D为Fe2O3、A为SO2,B为SO3,C是一种强酸,C为硫酸;G、H为Al2O3和Fe中的一种;由G+HNO3→M+NO↑分析可知G为Fe,H为Al2O3;M应为硝酸铁或硝酸亚铁;联系反应④:M+H2SO4→F+NO↑知,M为硝酸亚铁;F为硝酸铁;E应氢氧化铁,氢氧化铁分解生成氧化铁,氧化铁与铝发生铝热反应生成铁和氧化铝。
2Fe2O3+8SO2可知D为Fe2O3、A为SO2,B为SO3,C是一种强酸,C为硫酸;G、H为Al2O3和Fe中的一种;由G+HNO3→M+NO↑分析可知G为Fe,H为Al2O3;M应为硝酸铁或硝酸亚铁;联系反应④:M+H2SO4→F+NO↑知,M为硝酸亚铁;F为硝酸铁;E应氢氧化铁,氢氧化铁分解生成氧化铁,氧化铁与铝发生铝热反应生成铁和氧化铝。
(1)根据以上分析可知A、E的化学式分别是SO2、Fe(OH)3。(2)反应④的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。反应⑦的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。反应⑩的化学方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。(3)根据以上分析可知在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的②⑧。(4)检验M溶液中亚铁离子的方法为加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+。(5)铁元素化合价从+3价升高到+6价,失去3个电子,氮元素化合价从+5价降低到+3价,得到2个电子,根据电子得失守恒可知反应的方程式为Fe2O3+3KNO3+4KOH
2Fe+Al2O3。反应⑩的化学方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。(3)根据以上分析可知在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的②⑧。(4)检验M溶液中亚铁离子的方法为加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+。(5)铁元素化合价从+3价升高到+6价,失去3个电子,氮元素化合价从+5价降低到+3价,得到2个电子,根据电子得失守恒可知反应的方程式为Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O,双线桥标出电子转移方向和数目为
2K2FeO4+3KNO2+2H2O,双线桥标出电子转移方向和数目为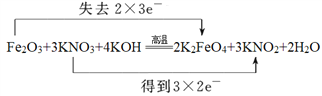 。(6)根据原子守恒可知还有氯化钠生成,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl。
。(6)根据原子守恒可知还有氯化钠生成,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】t℃时,将3mol A和2mol B气体通入体积为2L的固定密闭容器中,发生反应:2A(g)+B(g)x C(g),2min时反应达到平衡状态(温度不变),剩余1.5mol B,并测得C的浓度为0.5mol/L.试求:
(1)x=;
(2)A的转化率为多少?
(3)t℃时该反应的平衡常数.(注:写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
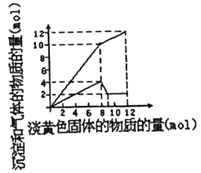
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
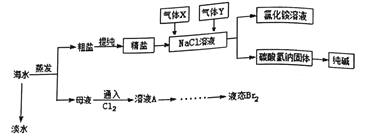
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B____________、C_________;B装置中如果忘加沸石,应_________;下图装置中有___________处错误。
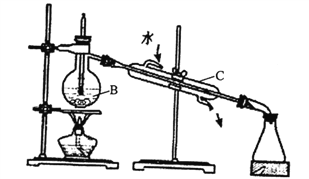
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器是__________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
a、溶解;b、依次加入过量的_________溶液、NaOH 溶液、c、_________;d、加适量盐酸; e、___________ (请补全缺少的试剂和实验步骤)。
(4)实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时:
①需要用托盘天平称量氯化钠的质量____________ g。
②下列实验操作会使配制结果偏高的是_______。
A.砝码生锈了 B.定容时俯视刻度线
C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水
E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切
(5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为_________、____________,你认为先通气体X的原因是_______________,该反应的化学方程式为__________________。
(6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: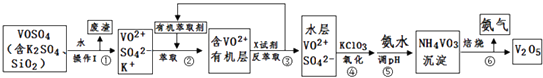
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: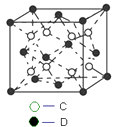
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 .
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(3)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(4)A的单质中δ键的个数为 , π键的个数为 .
(5)写出基态E原子的价电子排布式: .
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ gcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
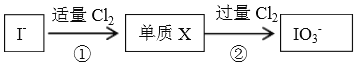
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ![]() ):n(
):n( ![]() )变化的关系如表:
)变化的关系如表:
n( | 91:9 | 1:1 | 9:91 |
Ph | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中c(H+)<c(OH﹣)
B.Na2SO3溶液中c(Na+)>c (SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO ![]() )+c(SO
)+c(SO ![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com