
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: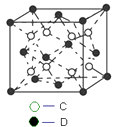
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 .
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(3)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(4)A的单质中δ键的个数为 , π键的个数为 .
(5)写出基态E原子的价电子排布式: .
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ gcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用ρ、NA的计算式表示)
【答案】
(1)水分子间之间存在氢键,氢键比范德华力更强
(2)HF>H2O>NH3
(3)三角锥形;sp3
(4)1;2
(5)3d104s1
(6)![]()
【解析】解:A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3 , 则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5 , 所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式3d104s1 , 则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素.(1)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的,所以答案是:水分子间之间存在氢键,氢键比范德华力更强;(2)由于非金属性F>O>N,故氢化物稳定性:HF>H2O>NH3 ,
所以答案是:HF>H2O>NH3;(3)A的最简单氢化物为NH3 , 为三角锥形结构,分子中N原子形成3个N﹣H键,含有1对孤对电子,杂化轨道数目为4,故N原子采取sp3杂化,
所以答案是:三角锥形;sp3;(4)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,
所以答案是:1;2;(5)E是铜元素,根据构造原理知,其基态原子的核外电子排布式[Ar]3d104s1 , 故基态Cu原子的价电子排布式为:3d104s1 ,
所以答案是:3d104s1;(6)白色球为F、黑色球为Ca,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8× ![]() +6×
+6× ![]() =4,则晶胞质量=4×
=4,则晶胞质量=4× ![]() g=
g= ![]() g,晶胞的体积=
g,晶胞的体积= ![]() g÷ρ gcm﹣3=
g÷ρ gcm﹣3= ![]() cm3 , 故晶胞边长a=
cm3 , 故晶胞边长a= ![]() cm,
cm,
所以答案是: ![]() .
.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )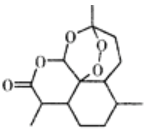
A.治疗疟疾的青蒿素(如右图),分子式为C15H20O5
B.甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种
C.对三联苯 ![]() 分子中至少有16个原子共平面
分子中至少有16个原子共平面
D.油脂和乙烯在一定条件下都能与水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A. Na2CO3、AgNO3、HNO3B. AgNO3、Na2CO3、HCl
C. AgNO3、Na2CO3、HNO3D. AgNO3、K2CO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体, C 是一种强酸。

请填写下列空白:
(1)写出下列物质的化学式:A:___________ E:_____________。
(2)写出反应④的离子方程式:______________________。
写出反应⑦的化学方程式:______________________。
写出反应⑩的化学方程式:______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号) 。
(4)写出检验M溶液中阳离子的方法:______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目:___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3 , 此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为、 .
(2)滤渣A的主要成分是;硅铝酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝溶解,下列试剂中最好选用(填编号).
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 , 配位数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中,能大量共存的是( ) ①酸性溶液中:Fe2+、Al3+、NO ![]() 、Cl﹣、I﹣
、Cl﹣、I﹣
②pH=13的溶液:Na+、CO ![]() 、SO
、SO ![]() 、AlO
、AlO ![]() 、S2﹣
、S2﹣
③水电离出来的c(H+)=10﹣13mol/L的溶液:NH4+、K+、NO ![]() 、S2O
、S2O ![]()
④加入铝片能放出H2的溶液:Na+、HCO ![]() 、Cu2+、SO
、Cu2+、SO ![]()
⑤滴加石蕊试液显红色的溶液:Fe3+、NH ![]() 、Cl﹣、NO
、Cl﹣、NO ![]() .
.
A.①②
B.②③
C.②④⑤
D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔质量就等于物质的式量
B. 摩尔质量就是物质式量的6.02×1023倍
C. HNO3的摩尔质量是63 g
D. 硫酸和磷酸的摩尔质量相等,都是98 g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com