
【题目】除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A. Na2CO3、AgNO3、HNO3B. AgNO3、Na2CO3、HCl
C. AgNO3、Na2CO3、HNO3D. AgNO3、K2CO3、HNO3
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )
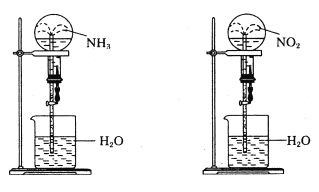
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
A.x=1
B.2 min内A的反应速率为0.3 mol/(Lmin)
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3mol A和2mol B气体通入体积为2L的固定密闭容器中,发生反应:2A(g)+B(g)x C(g),2min时反应达到平衡状态(温度不变),剩余1.5mol B,并测得C的浓度为0.5mol/L.试求:
(1)x=;
(2)A的转化率为多少?
(3)t℃时该反应的平衡常数.(注:写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)=1xl0﹣13 mol/L的溶液中:K+、Na+、SiO ![]() 、SO
、SO ![]()
B.1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO ![]() 、Cl﹣
、Cl﹣
C.在c(OH﹣):c(H+)=1×1012的溶液:NH ![]() 、Ca2+、C1﹣、K+
、Ca2+、C1﹣、K+
D.甲基橙显黄色的溶液:Na+、CO ![]() 、NO
、NO ![]() 、SO
、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
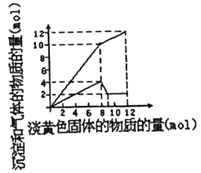
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
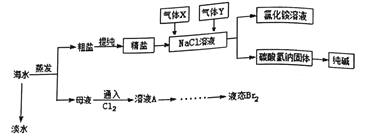
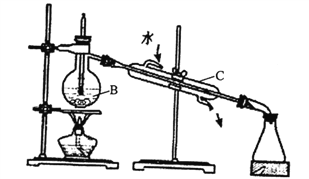
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B____________、C_________;B装置中如果忘加沸石,应_________;下图装置中有___________处错误。
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器是__________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
a、溶解;b、依次加入过量的_________溶液、NaOH 溶液、c、_________;d、加适量盐酸; e、___________ (请补全缺少的试剂和实验步骤)。
(4)实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时:
①需要用托盘天平称量氯化钠的质量____________ g。
②下列实验操作会使配制结果偏高的是_______。
A.砝码生锈了 B.定容时俯视刻度线
C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水
E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切
(5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为_________、____________,你认为先通气体X的原因是_______________,该反应的化学方程式为__________________。
(6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: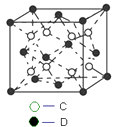
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 .
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(3)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(4)A的单质中δ键的个数为 , π键的个数为 .
(5)写出基态E原子的价电子排布式: .
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ gcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种物质:① NO、②浓H2SO4、③浓HNO3、④ NaHCO3、⑤SO2。其中,遇空气变红棕色的是______(填序号,下同);能使蔗糖变黑的是______;能使品红溶液褪色的是_________。受热分解产生CO2的是______,写出该反应化学方程式__________;与铜反应产生红棕色气体的是______,写出该反应化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com