
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
【答案】3NO2+H2O=2HNO3+NO饱和NaHCO3溶液或酸性KMnO4溶液等Na2O + CO2 == Na2CO3焰色反应![]() AlO2+4H+=Al3++2H2O取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则C中含Fe2+离子
AlO2+4H+=Al3++2H2O取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则C中含Fe2+离子
【解析】
(1)常温时B为红棕色气体,C为无色气体,说明B为NO2,C为NO,A为HNO3,B生成C的化学方程式是:3NO2 + H2O = 2HNO3 + NO,故答案为:3NO2 + H2O = 2HNO3 + NO;
(2)常温时A为气态氢化物,B为淡黄色固体,说明B为S,A为H2S,C为SO2,则CO2中混有少量气体SO2杂质时,可以选用饱和的NaHCO3溶液或酸性KMnO4溶液除去SO2,故答案为:饱和NaHCO3溶液或酸性KMnO4溶液等;
(3)常温时0.1mol/LC溶液的pH值为13,则C溶液中c(OH-)= 0.1mol/L,说明C是一元强碱,结合B为工业制玻璃的主要原料之一,说明B是碳酸钠,C为氢氧化钠,A为氧化钠或过氧化钠,则三种物质中含有的相同金属元素是钠元素,检验钠元素常用焰色反应,现象是焰色为黄色;
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,符合题意的是A为氧气,B为CO,C为CO2,①②③④对应的化学反应方程式分别为:2C+O2![]() 2CO、2CO+O2
2CO、2CO+O2![]() 2CO2、CO2+C
2CO2、CO2+C![]() 2CO、C+O2
2CO、C+O2![]() CO2,故C的电子式为:
CO2,故C的电子式为:![]() ;
;
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性,说明该金属是铝,A为氧化铝,B溶液含有铝离子、C溶液含有偏铝酸根离子,偏铝酸根离子反应生成铝离子的反应方程式是:AlO2- + 4H+ = Al3+ + 2H2O;
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,说明A为单质铁,B为Fe2+、C为Fe3+,①②③④对应的反应方程式可以是:Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3、2FeCl3+Fe=3FeCl2、2Fe+3Cl2![]() 2FeCl3,则检验Fe2+的实验方法是:取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则B中含Fe2+离子,也可以用氢氧化钠沉淀法或K3[Fe(CN)6]沉淀法等,但不能用酸性高锰酸钾,故答案为:取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则C中含Fe2+离子(用氢氧化钠沉淀法或K3[Fe(CN)6]沉淀法等合理均可)。
2FeCl3,则检验Fe2+的实验方法是:取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则B中含Fe2+离子,也可以用氢氧化钠沉淀法或K3[Fe(CN)6]沉淀法等,但不能用酸性高锰酸钾,故答案为:取少量B溶液于试管中,滴加少量KSCN溶液,无明显现象,再滴加少量新制氯水,若出现血红色则C中含Fe2+离子(用氢氧化钠沉淀法或K3[Fe(CN)6]沉淀法等合理均可)。


科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液: K+、Al3+、Cl-、SO42-
B. 含有大量NH4+的溶液: Na+、S2-、OH-、NO3-
C. 通有足量NO2的溶液: K+、Na+、SO42-、AlO2-
D. 强酸性溶液: Na+、Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤正确的是
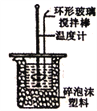
A. 为了减小热量损失,倒入NaOH溶液应该多次迅速倒人
B. 用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
C. 烧杯如不盖硬纸板,不影响测得的中和热数值
D. 先用一支温度计测量盐酸温度,再用另一支温度计测量氢氧化钠溶液温度,并做好记录
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,恒容的密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
A. c(O2)=0.3mol/L B. c(SO3)+c(SO2)=0.4 mol/L
C. c(S03)=0.4 mol/L D. c(S03)+c(SO2)=0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:

(1)A-F的反应类型是____;G中含氧官能团的名称是____。
(2)A-C的反应方程式是________。
(3)H的结构简式是________,E的结构简式是____。
(4)有的同学认为B中可能没有氯原子,你的观点是________(填“同意”或“不同意”)你的理由_______。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____(写结构简式);只含有两个甲基的同分异构体有____种。
①相对分子质量比C少54;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 |
|
|
|
键能 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 反应中![]() 为吸热反应
为吸热反应
B. 过程![]() 放出能量
放出能量
C. 反应中![]() ,N2与F2的总能量小于NF3的总能量
,N2与F2的总能量小于NF3的总能量
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=一akJ/mol
O2(g)+2SO2(g)![]() 2S03(g)△H=-bkJ/mol
2S03(g)△H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。

②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______(用K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,![]() =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属按原子序数递增的顺序,其单质的性质变化不正确的是( )
A.单质的还原性依次增强
B.与水反应生成的氢氧化物碱性增强
C.与氧气反应的剧烈程度增强
D.熔点、沸点依次升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com