
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液: K+、Al3+、Cl-、SO42-
B. 含有大量NH4+的溶液: Na+、S2-、OH-、NO3-
C. 通有足量NO2的溶液: K+、Na+、SO42-、AlO2-
D. 强酸性溶液: Na+、Fe3+、NO3-、Cl-
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标况下,11.2LCCl4中含有共价键数目为2NA
B. 1 mol Cl2 与足量的铁反应转移的电子数目是3NA
C. 2molSO2和1mol18O2充分反应,产物中含18O原子数为2NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。

溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | ________ |
②AlCl3溶液 | 通过量NH3 | ________ |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | ________ |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:
Ni(OH)2+5CH3NC=(CH3NC)4Ni +CH3NCO+H2O
⑴Ni2+基态核外电子排布式为___________。
⑵CH3NC(其结构简式为![]() )分子中碳原子轨道的杂化类型是___________;
)分子中碳原子轨道的杂化类型是___________;
 1 molCH3NC中σ键的数目为___________。
1 molCH3NC中σ键的数目为___________。
⑶用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___________。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___________。
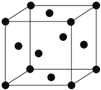
⑷Ni单质的晶胞结构如右图所示,每个晶胞中含Ni原子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是( )
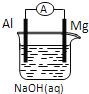
A. Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B. 负极反应式为:Al+4OH--3e-=AlO2-+2H2O
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. 原电池工作过程中溶液PH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com