
1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
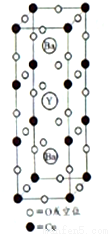
(1)汞位于第六周期,且与锌同族,写出Hg的最外层电子排布式________。
(2)Ge元素属于_____(从下列选项中选择)
A.s区 B.类金属 C.非金属 D.过渡金属 E.准金属
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是________
(4)NH3也常作制冷剂,其分子构型是______,NH3的沸点(239.6℃)高于N2沸点的主要原因是_____
(5)图示材料的理想化学式(无空位时)为_____,若Y(钇)元素的化合价为+3,则Cu的平均化合价为___
(6)金属铜为立方晶胞,空间利用率为74%,晶胞边长为a cm,铜的相对原子质量为63.5,阿伏伽德罗常数为NA。则金属铜的晶体密度ρ=_____g/cm3(只含一个系数,用a、NA表示)
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:实验题
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50mL和5 mol·L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
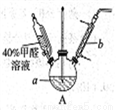
①仪器b的名称是___________,作用为__________。
②能说明甲醛具有还原性的实验现象是___________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
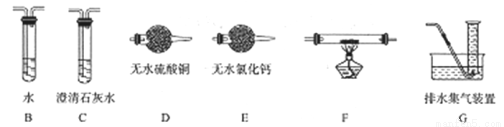
依次连接的合理顺序为A→B→___→___→___→___G,装置B的作用是_________。
(3)已知: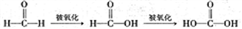 。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
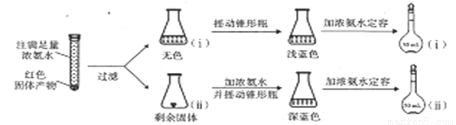
已知:Cu2O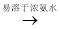 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+](蓝色)。
[Cu(NH3)4]2+](蓝色)。
①摇动锥形瓶ⅰ的目的是_____________。
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为______________。
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为_____________。
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:填空题
(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、
_____和_____;含有的Fe3+的核外电子排布式为______。
(2)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是____;碳原子采取sp杂化,1mol该物质中含有的π键数目为______。含有的三种非金属元素的电负性由大到小的顺序是______。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是______。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As原子的杂化方式为___,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4,SnCl4分子的空间构型为______。
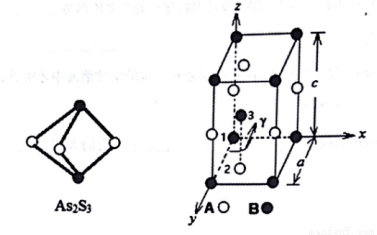
(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为_____,该晶胞参数为a=250.4pm,c=666.1pm,y=120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____,计算上述晶体中A和B两原子间的最小核间距为____。(保留四位有效数字。已知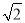 =1.141,
=1.141, 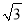 =1.732.)
=1.732.)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:选择题
下列方程式书写正确的有
①向NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去:2MnO4-+5H2C2O4=2Mn2-+10CO2↑+2H2O+6OH-
③碳酸的电离方程式:H2CO3 2H++CO32-
2H++CO32-
④NaClO溶液中CIO-的水【解析】
CIO-+H2O=HClO+OH-
⑤酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O
⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源:2017届四川省南充市高三第二次高考适应性考试理综化学试卷(解析版) 题型:选择题
次磷酸(H3PO2)为一元酸,具有较强的还原性。可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴膜),下列说法描述错误的是

A. 阳极室反应为:2H2O-4e-=O2↑+4H+
B. ab,ef均为阳膜,cd为阴膜
C. 若将稀H2SO4改为H3PO2,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4
D. 通电后产品室中的H+离子向原料室迁移
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:填空题
下列反应可用于合成CH3OH:
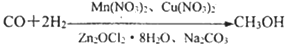
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。
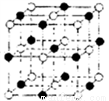
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是原了序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. X的最高价氧化物对应水化物的酸性比R的强
C. X、R分别与Y形成的常见化合物中化学键类型相同
D. 元素W、R的简单离子具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高二下学期第一次教学检测化学试卷(解析版) 题型:选择题
已知苏糖的结构简式为: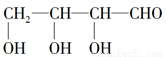 有关苏糖的说法不正确的是( )
有关苏糖的说法不正确的是( )
A. 苏糖能发生银镜反应
B. 苏糖属于单糖
C. 苏糖在一定条件下,能发生加成和取代反应
D. 苏糖与葡萄糖互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com