

 .
.分析 菱锰矿用稀酸酸浸,MnCO3、SiO2、FeCO3、Al2O3与硫酸反应,产生二氧化碳,可以循环利用,SiO2不与硫酸反应,过滤得到SiO2沉淀,滤液中含有硫酸镁、硫酸亚铁、硫酸铝及剩余的硫酸,向滤液中加入二氧化锰,将亚铁离子氧化成铁离子,加入碳酸氢钾调节PH值,过滤得滤渣中含有氢氧化铁和氢氧化铝,滤渣加入氢氧化钾溶液,氢氧化铝溶解生成偏铝酸钾,过滤除去氢氧化铁,滤液中通入二氧化碳生成 氢氧化铝沉淀和碳酸氢钾溶液,碳酸氢钾溶液可以循环利用,过滤Ⅱ后得到的滤液中含有硫酸锰,经氧化得高锰酸钾溶液,低温蒸干后得高锰酸钾晶体,据此答题.
解答 解:菱锰矿用稀酸酸浸,MnCO3、SiO2、FeCO3、Al2O3与硫酸反应,产生二氧化碳,可以循环利用,SiO2不与硫酸反应,过滤得到SiO2沉淀,滤液中含有硫酸镁、硫酸亚铁、硫酸铝及剩余的硫酸,向滤液中加入二氧化锰,将亚铁离子氧化成铁离子,加入碳酸氢钾调节PH值,过滤得滤渣中含有氢氧化铁和氢氧化铝,滤渣加入氢氧化钾溶液,氢氧化铝溶解生成偏铝酸钾,过滤除去氢氧化铁,滤液中通入二氧化碳生成 氢氧化铝沉淀和碳酸氢钾溶液,碳酸氢钾溶液可以循环利用,过滤Ⅱ后得到的滤液中含有硫酸锰,经氧化得高锰酸钾溶液,低温蒸干后得高锰酸钾晶体,
(1)CO2的电子式为 ,故答案为:
,故答案为: ;
;
(2)根据上面的分析可知,第一次“氧化”加入MnO2的目的是将亚铁离子氧化成铁离子,该过程中发生反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:将亚铁离子氧化成铁离子;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)根据上面的分析可知,上述流程中可以循环利用的物质有CO2、KHCO3,故答案为:CO2、KHCO3;
(4)“调节pH值”过程中,氢离子与碳酸氢根离子反应,铁离子和铝离子都生成氢氧化物沉淀,所以发生反应的阳离子有H+、Fe3+、Al3+,
故答案为:H+、Fe3+、Al3+;
(5)第二次“氧化”中,在少量AgNO3溶液作催化剂的条件下,过量的K2S2O8溶液将锰离子氧化成高锰酸根,反应的离子方程式为2Mn2++5S2O82-+8H2O$\frac{\underline{\;AgNO_{3}\;}}{△}$5SO42-+2MnO4-+16H+,
故答案为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;AgNO_{3}\;}}{△}$5SO42-+2MnO4-+16H+;
(6)由于高锰酸钾在高温下会分解,所以制取高锰酸钾最终采用“低温蒸干”的方法,
故答案为:高锰酸钾在高温下会分解;
(7)常温下,将156gAl(OH)3溶于1L水中,氢氧化铝在水中存在沉淀的溶解平衡,水电离平衡,所以所得分散系中存在的动态平衡共有2个,该温度下Al(OH)3溶液中Ksp[Al(OH)3]=c(Al3+)•c3(OH-)=c(Al3+)•33•c3(Al3+)=27c4(Al3+),所以溶解度S=c(Al3+)=$\root{4}{\frac{1.3×10{\;}^{-33}}{27}}$mol•L-1,
故答案为:2;$\root{4}{\frac{1.3×10{\;}^{-33}}{27}}$.
点评 本题考查制备实验方案的设计,为高频考点,把握流程中混合物分离提纯、除杂及发生的反应为解答的关键,侧重分析、实验、推断及计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 不断鼓入空气 | C. | 加入FeS2 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
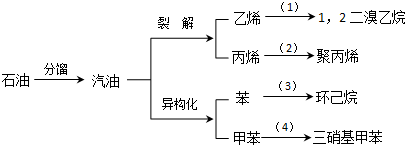
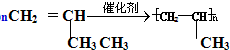 (加成聚合反应)
(加成聚合反应)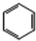 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$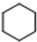 (加成反应)
(加成反应)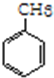 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$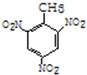 +3H2O(取代反应)
+3H2O(取代反应)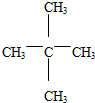 .
. .
.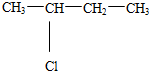 (不考虑顺反异构).
(不考虑顺反异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CHO | B. | CH3CH2COOH | C. | CH3COCH3 | D. | CH3CH2OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等. | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
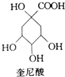 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )| A. | 分子式为C7H12O6 | B. | 不能发生加成反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 1mol奎尼酸最多能消耗6molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com