
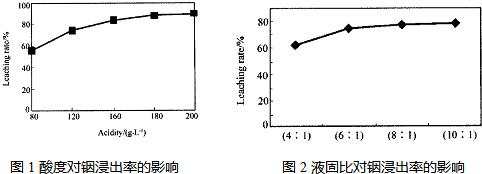

分析 (1)①根据酸度的定义计算,酸度为196时,说明1L溶液中硫酸的质量为196g,即硫酸为2mol,故浓度为2mol/L;
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)闪锌矿(主要含ZnS)的焙烧可生成ZnO等,含尘烟气含有含硫氧化物,可用于制备硫酸,焙烧后的固体用硫酸浸取,浸出液进行净化可知硫酸锌溶液,电解硫酸锌溶液可得到锌和硫酸,电解液中含有硫酸,可循环利用,
①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.
解答 解:(1)①酸度为196时,说明1L溶液中硫酸的质量为196g,硫酸的物质的量为$\frac{196g}{98g/mol}$=2mol,浓度为2mol/L,故答案为:2mol•L-1;
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓、Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
点评 本题以信息题目的形式考查金属冶炼的一般原理,做题时注意题中给予的关键信息,如闪锌矿的组成,酸度等问题,本题较为综合,具有一定难度.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
.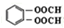 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
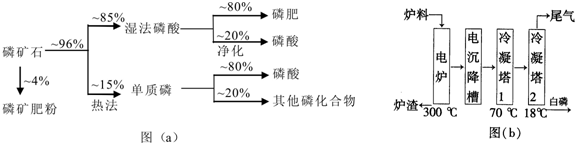
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
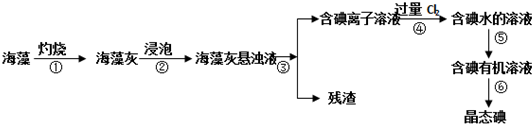
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
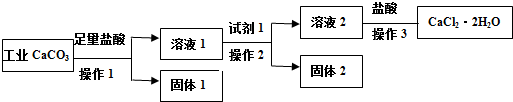
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com