
分析 (1)碘是合成甲状腺激素的主要元素;
(2)根据碘、钙的生理功能,以及葡萄糖的生理功能和糖尿病的成因判断;
(3)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘,碘遇淀粉变蓝色,据此分析;
(4)先由电流、时间求出电量,再根据电量与一个电子的电量求出电子的个数,再根据电子与氢气的关系式计算氢气的体积.
解答 解:(1)人体摄入的碘主要是来自海产品和碘盐,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故选B;
(2)A.甲状腺机能亢进是因碘摄入太多造成的,故A错误;
B.钙主要存在于骨胳和牙齿中,使骨和牙齿具有坚硬的结构支架,缺乏幼儿和青少年会患佝偻病,老年人会患骨质疏松,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故B错误;
C.碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大,故C正确;
D.糖尿病是因血糖浓度过高,造成尿中含有大量的葡萄糖的病症,故D错误;
故选C;
(3)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;该反应中KI是还原剂,还原剂对应的产物是氧化产物,KIO3是氧化剂,氧化剂对应的产物是还原产物,所以氧化产物、还原产物都是碘,物质的量之比为 5:1;该反应中有碘单质生成,碘遇淀粉变蓝色,所以观察到溶液变蓝色,
故答案为:5KI+KIO3+6HCl═6KCl+3I2+3H2O;5:1;溶液变蓝;
(4)l0min通过的电量为(10×60)S×l2A=7200C,通过的电子个数为$\frac{7200C}{1.60×1{0}^{-19}C}$=4.5×1021
设生成氢气体积为V,
2H++2e-=H2↑.
2NA 22.4L
4.5×1021 V
所以V=0.837 L
故答案为:0.837.
点评 本题考查了化学反应方程式及电极反应式的书写等知识点,难度不大,(3)题易错,注意氧化产物、还原产物物质的量的判断,特别是氧化产物和还原产物是同一物质的化学反应.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②①③④⑤ | C. | ②①③⑤④ | D. | ②①④③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

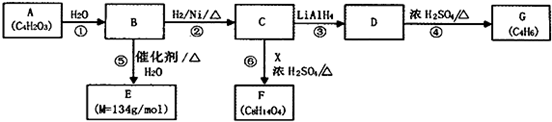
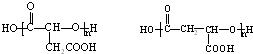 .
.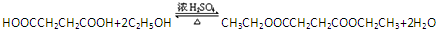 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应制取氢气 | B. | 氯化铵和氢氧化钙制取氨气 | ||
| C. | 浓盐酸和二氧化锰反应制取氯气 | D. | 氯气与石灰乳反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
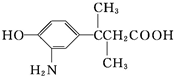 ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )| A. | 该物质在一定条件下能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱(1H-NMR)上共有7个峰 | |
| C. | 1 mol该物质最多能与含1 mol Br2的溴水发生取代反应 | |
| D. | 该物质能与Na、NaOH、NaHCO3、盐酸等物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 相关物质 | 相关说法 |
| A | 1mol CH3COONa和少量CH3COOH溶于水所得的中性溶液中 | CH3COO-数目为NA |
| B | Na2O和Na2O2的混合物共1mol | 阴离子数目可能为1.5NA |
| C | 向含2mol H2SO4的浓硫酸中加入足量的Zn粉,加热充分反应 | 转移的电子数为2NA |
| D | 3.0g由淀粉和葡萄糖组成的混合物中 | 所含的碳原子数为0.1NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com