
| 烧杯和溶液的质量/g | 烧杯和剩余溶液的质量/g | 量筒中溶液的质量/g | 量筒中溶液的体积/cm3 | 硫酸铜溶液的密度ρ/(g•cm-3) |
| 49.2 | 28.2 | 21 | 20 | 1.05 |
分析 (1)天平应放在水平台面上,调节天平横梁时,指针应向指针偏离的反方向调节;
(2)明确天平标尺的分度值,由m物=m砝码+m游码计算烧杯和剩余溶液的质量,从而得到倒入量筒中溶液的质量,根据ρ=计算溶液的密度;
(3)根据物体的沉浮条件,运用密度和阿基米德原理公式推导.
解答 解:(1)用天平测量物体的质量时,首先把天平放在水平台上,把游码放在标尺左端的零刻线处.然后调节平衡螺母,使横梁平衡,在调节过程中,若指针偏向分度盘的右侧,应将平衡螺母向左边调节;
故答案为:水平台;左;
(2)由图可知天平标尺分度值为0.2g,烧杯和剩余溶液的质量:m=20g+5g+3.2g=28.2g,
量筒中溶液的质量:m液=49.2g-28.2g=21g,
硫酸铜溶液的密度:ρ═1.05g/cm3;
故答案为:28.2;21;1.05;
(3)当血液悬浮时,根据物体的浮沉条件可知:G=F浮,
ρ物gV物=ρ液gV排,
因为物体悬浮时,V物=V排,
所以:ρ物=ρ液,即血液的密度等于硫酸铜溶液的密度.
故答案为:当血液悬浮时,根据物体的浮沉条件可知:G=F浮,
ρ物gV物=ρ液gV排,
因为物体悬浮时,V物=V排,
所以:ρ物=ρ液,即血液的密度等于硫酸铜溶液的密度.
点评 本题通过测量人体血液密度综合考查天平的使用、液体的密度测量和浮沉条件应用等知识,综合性强,都是一些常考基础知识,需要掌握好.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 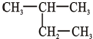 2-乙基丙烷 2-乙基丙烷 | B. |  3-丁醇 3-丁醇 | C. | 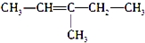 3-甲基-2-戊烯 3-甲基-2-戊烯 | D. | 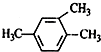 1,3,4-三甲苯 1,3,4-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al、Ga均处于ⅢA族 | B. | Ga2O3可与盐酸反应生成GaCl3 | ||
| C. | Ga(OH)3可与NaOH溶液生成NaGaO2 | D. | 酸性:Al(OH)3>Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 16种 | C. | 36种 | D. | 44种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:实验题
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
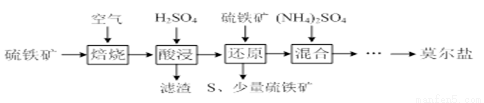
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2 倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是( )
A. Y的最高价氧化物对应水化物的酸性比W的强
B. W的气态氢化物比X的稳定
C. 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
D. XY2与ZY2中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+H2O
D.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com