
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
D. c(CH3COOH)与c(CH3COO-)之和始终保持不变
【答案】C
【解析】
A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大;当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
B.根据一水合氨的电离平衡常数可知,该比值与氢氧根离子成反比,电离氨水的过程中,溶液中氢氧根离子浓度逐渐增大;
C.CH3COOH和NH3H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显中性,根据电荷守恒可知c(NH4+)=c(CH3COO-),;
D.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但是溶液体积增大,二者的浓度之和逐渐减小。
A.酸溶液、碱溶液抑制水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度又逐渐减小,所以在滴加氨水的过程中,水的电离程度先增大后减小,选项A错误;
B.当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由一水合氨的电离平衡常数Kb=![]() 可知:随着氨水的加入,c(H+)逐渐减小,c(OH-)逐渐增大,
可知:随着氨水的加入,c(H+)逐渐减小,c(OH-)逐渐增大,![]() 逐渐减小,选项B错误;
逐渐减小,选项B错误;
C.当加入氨水的体积为10mL时,n(CH3COOH)=n(NH3H2O),由于二者的电离常数相等,所以溶液显示中性,c(H+)= c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),选项C正确;
D.n(CH3COOH)+n(CH3COO-)=0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,选项D错误;
故合理选项是C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略)在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:

(1)装置A的作用是________
(2)试管①中发生的主要反应有:C8H18![]() C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 ![]() C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)写出试管③中反应的任意一个化学方程式________________。
(4)试管②中的少量液体的组成是________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯化合物在工农业生产和日常生活中有着广泛的用途。
(1)工业上用氯气制备漂白粉,某研究小组利用下列装置制备漂白粉。

①漂白粉的有效成分是_____________(填化学式)。漂白粉放置在空气中一段时间后会失效,原因是(写出有关反应的化学方程式)________________________。
②装置A中发生反应的化学方程式为___________________________________。
③装置B中试剂a为_________,作用是________________________________。
(2)ClO2常用于自来水的消毒、木质纸浆的漂白。已知:NaCl+3H2O![]() NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
物质 | 熔点/℃ | 沸点/℃ |
ClO2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图如下:

理论上每生成1molClO2,外界至少补充X气体________ mol。从ClO2发生器中分离出ClO2可采用的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=11的X、Y两种碱溶液各5 mL,分别稀释至500 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. 稀释后X溶液中水的电离程度比Y溶液中水电离程度小
B. 若X为强碱,则a=9
C. 若X、Y都是弱碱,则a的值一定小于9
D. 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在体积不变的密闭容器中,有可逆反应X(s)+2Y(g) ![]() 2Z(g) △H<0,下列说法—定正确的是
2Z(g) △H<0,下列说法—定正确的是
A. 0.2molX和0.4molY充分反应,Z的物质的量可能会达到0.35mol
B. 从容器中移出部分反应物X,则正反应速率将下降
C. 当△H不变时,反应将达到平衡
D. 向反应体系中继续通入足量Y气体,X有可能被反应完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图均为电化学装置,下列有关叙述正确的是( )
A.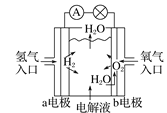 氢氧燃料电池示意图中,b电极发生氧化反应
氢氧燃料电池示意图中,b电极发生氧化反应
B. 电解氯化铜溶液装置中,铁棒上析出红色固体
电解氯化铜溶液装置中,铁棒上析出红色固体
C. 电镀实验装置中,若电镀前两电极质量相等,电镀完成后二者质量差为5.12 g,则电镀时待镀铁制品应与电源负极相连,外电路转移0.08 mol电子
电镀实验装置中,若电镀前两电极质量相等,电镀完成后二者质量差为5.12 g,则电镀时待镀铁制品应与电源负极相连,外电路转移0.08 mol电子
D. 交换膜法电解饱和NaCl溶液原理图中,离子交换膜应为阴离子交换膜
交换膜法电解饱和NaCl溶液原理图中,离子交换膜应为阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com