
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
【答案】C
【解析】
充满 NO2 和 O2 的试管倒立于水槽中,发生反应可能为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,试管中剩余
,试管中剩余![]() 体积的气体可能为NO或O2。
体积的气体可能为NO或O2。
设原气体体积为8L,则剩余气体为1L,根据方程式4NO2+O2+2H2O=4HNO3讨论
①若剩余的1L气体为O2,则反应的二氧化氮和氧气共7L,V(NO2)=![]() ×7L=5.6L,V(O2)=8L-5.6L=2.4L,则二氧化氮和氧气的体积比为5.6L:2.4L=7:3,②正确;
×7L=5.6L,V(O2)=8L-5.6L=2.4L,则二氧化氮和氧气的体积比为5.6L:2.4L=7:3,②正确;
②若剩余的1L气体为NO,即相当于剩余3LNO2,则反应的二氧化氮和氧气共5L,V(O2)=![]() ×5L=1L,V(NO2)=8L-1L=7L,则二氧化氮和氧气的体积比为7:1,③正确;故答案为:C。
×5L=1L,V(NO2)=8L-1L=7L,则二氧化氮和氧气的体积比为7:1,③正确;故答案为:C。


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 用惰性电极电解MgCl2 溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向氯化铝溶液中滴加少量Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
C. 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
D. FeCl3溶液与NaAlO2溶液混合:Fe3++ 3AlO2-=Fe(AlO2)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
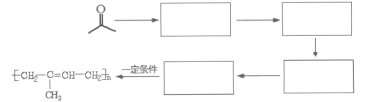
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,I是一种萜类化合物,它的合成路线如图所示:
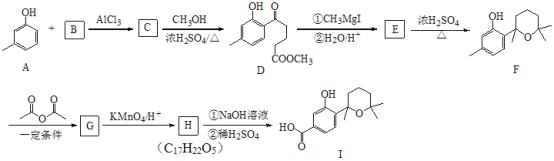
已知:
Ⅰ.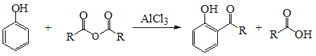
Ⅱ.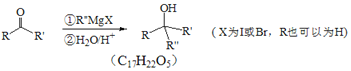
Ⅲ.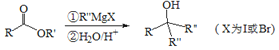
回答下列问题:
(1)A的名称是________,A+B→C的反应类型是___________;
(2)F的分子式_______________,其分子中所含官能团的名称是____________;
(3)H→I第一步的化学反应方程式_________________;
(4)B含有一个环状结构,其结构简式为_________________;
它的同分异构体有多种,其中符合下列条件的有___________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与NaHCO3反应生成CO2
(5)流程中设计F→G这步反应的作用_________________;
(6)F与(CH3CO)2O按物质的量1∶1发生反应生成G的化学方程式为____________;
(7)请以CH3COCH3、CH3CH2MgBr为原料,结合题目所给信息,制备高分子化合物 的流程。
的流程。
例如:原料![]() ……目标化合物
……目标化合物
___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是

A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。

(1)请写出该反应的化学方程式:_____。
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2 表示该反应的平均速率 v(H2)为_____。
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应为NH3_____(填:吸收或放出)_____kJ 能量。事实上,将 1molN2 和3molH2 放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_________。
(4)下列叙述能判断该反应达到平衡状态的是_____(填字母代号)。
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()

①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
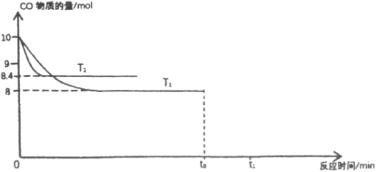
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广瓶内水面的变化情况:

(1)上述实验过程中发生反应的化学方程式为__________________________________。
(2)甲同学实验中广瓶内水面上升明显小于瓶内空气体积的![]() ,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的
,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的![]() ,下列对这两种现象解释合理的是________
,下列对这两种现象解释合理的是________
A.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
B.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
C.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
D.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
(3)在实验室里,某同学取一小块金属钠做钠与水反应的实验。将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①__________,②__________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
D. c(CH3COOH)与c(CH3COO-)之和始终保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com