
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()

①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
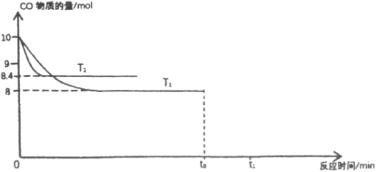
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
【答案】![]()
![]() 太阳能 电能 化学能 阴极
太阳能 电能 化学能 阴极 ![]() < 放热 7
< 放热 7 
【解析】
(1)硫化氢为共价化合物,原子之间通过共用电子对达到稳定结构书写电子式;
(2)①根据物质的性质与用途作答;
②该装置为光伏电池为电源的电解池;
③CO2在ZnO@石墨烯电极上转化为CO,发生得到电子的还原反应,为阴极,石墨烯电极为阳极,发生失去电子的氧化反应;
(3)根据化学反应速率与平衡图像中,“先拐先平数值大”来判断温度大小;
②![]() 温度下,设H2S的物质的量为x mol,容器体积为V,列出三段式,依据反应平衡常数计算作答。
温度下,设H2S的物质的量为x mol,容器体积为V,列出三段式,依据反应平衡常数计算作答。
③根据反应平衡体系可知,反应是气体体积分数不变的平衡,增大体积平衡不移动。
(1)硫化氢的电子式为:![]() ;
;
(2)①利用硅单质的半导体性能可制成太阳能电池,因此材料为硅单质,b项正确,
答案选b;
②该装置中,硅单质将太阳能(光能)转化为电能后,再利用电解原理将电能转化为化学能,
故答案为:太阳能;电能;化学能;
③由题中信息可知,石墨烯电极上发生氧化反应,则石墨烯电极为阳极,因此,CO2在ZnO@石墨烯电极上转化为CO,发生得到电子的还原反应,为电解池的阴极,电极反应式为CO2+H++2e-=CO+H2O,
故答案为:阴极;CO2+2H++2e-=CO+H2O;
(3)①对于平衡:![]() ,升高温度反应速率会加快,从图像中可以看出,
,升高温度反应速率会加快,从图像中可以看出,![]() ;升高温度,CO的物质的量增大,平衡向逆反应方向移动,则正反应为放热反应,
;升高温度,CO的物质的量增大,平衡向逆反应方向移动,则正反应为放热反应,
故答案为:<;放热反应;
②![]() 温度下,设H2S的物质的量为x mol,容器体积为V,则
温度下,设H2S的物质的量为x mol,容器体积为V,则
![]()

因该反应平衡常数为![]() ,则K=
,则K=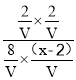 =0.1,则x=7,
=0.1,则x=7,
故答案为:7;
③对于平衡:![]() ,
,![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,平衡不移动,则CO的物质的量仍为8mol,其图像补全后为:
倍,平衡不移动,则CO的物质的量仍为8mol,其图像补全后为:
 ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量
B.向 AlCl3 溶液中逐滴 滴加氨水至过量
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量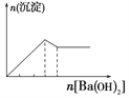
D.向澄清石灰水中缓缓 通入 CO2 至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. 图2中Y电极为阴极
B. 图2中总反应的化学方程式为:2AlCl3+6H2O2![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
C. 图1中电解质溶液的pH增大
D. 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. ![]() 在
在![]() 中燃烧可以生成
中燃烧可以生成![]() 和
和![]() 的混合物
的混合物
B. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C. 相同温度下,![]() 在同浓度的
在同浓度的![]() 和
和![]() 溶液中的溶解度不相同
溶液中的溶解度不相同
D. 电解精炼铜时,同一时间内阴极析出铜的质量比阳极溶解铜的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式错误的是
A.![]() 与盐酸反应:
与盐酸反应:![]()
B.![]() 溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
C.铝溶于氢氧化钠溶液: 2Al+2OH-+2H2O=2AlO2-+3H2↑
D.![]() 溶于NaOH溶液:
溶于NaOH溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
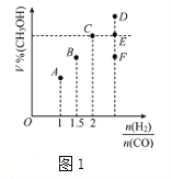

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略)在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:

(1)装置A的作用是________
(2)试管①中发生的主要反应有:C8H18![]() C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 ![]() C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)写出试管③中反应的任意一个化学方程式________________。
(4)试管②中的少量液体的组成是________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=11的X、Y两种碱溶液各5 mL,分别稀释至500 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. 稀释后X溶液中水的电离程度比Y溶液中水电离程度小
B. 若X为强碱,则a=9
C. 若X、Y都是弱碱,则a的值一定小于9
D. 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com