
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
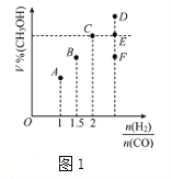

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图2所示。
【答案】4H2(g)+2NO2(g)= N2(g)+4H2O(g) △H=-1100.2kJ/mol DE 0.08mol/(L·min) 减小 F
【解析】
(1)依据盖斯定律解答;
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)①建立三段式,依据三段式计算比较;
②合比例等于化学计量数之比时,平衡时生成物的含量最大。
(1)由H2的燃烧热为285.8kJ/mol得①H2(g)+1/2 O2(g)=H2O(l)△H=-285.8KJ/mol,将已知热化学方程式编号为②N2(g)+2O2(g)=2NO2(g)△H=+133kJmol-1,③H2O(g)=H2O(l)△H=-44kJmol-1,由盖斯定律,①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJmol-1,故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJmol-1;
(2)A、因该反应生成物均为液态,则混合气体的平均式量始终保持不变,不能说明反应达到平衡状态,故A错误;
B、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,所以过程中CO2和H2的体积分数始终保持不变,故B错误;
C、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故C错误;
D、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故D正确;
E、1mol CO2生成的同时有3mol H-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故E正确;
故答案为DE;
(3)①H2和CO总共为3mol,且起始n(H2)/n(CO)=2,可知H2为2mol、CO为1mol,5min达到平衡时CO的转化率为0.4,则由题意建立如下三段式:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol):1 2 0
变化(mol):0.4 0.8 0.4
平衡(mol):0.6 1.2 0.4
容器的容积为2L,则△c(H2)=0.8 mol/2L=0.4mol/L,v(H2)=0.4mol/L/5min=0.08mol/(L·min);该温度下平衡时各物质浓度为c(CO)=0.3 mol/(L·min)、c(H2)=0.6mol/(L·min)、c(CH3OH)=0.2mol/(L·min),则化学平衡常数K=0.2/0.3×0.62,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Q=0.4/0.5×0.62>K,反应向逆反应进行,达新平衡时H2的转化率将减小,故答案为:0.08mol/(L.min);减小;
②混合比例等于化学计量数之比时,平衡时生成物的含量最大,故当n(H2)/n(CO)= 3.5时,达到平衡状态后,CH3OH的体积分数小于C点,故答案为:F。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是

A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()

①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广瓶内水面的变化情况:

(1)上述实验过程中发生反应的化学方程式为__________________________________。
(2)甲同学实验中广瓶内水面上升明显小于瓶内空气体积的![]() ,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的
,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的![]() ,下列对这两种现象解释合理的是________
,下列对这两种现象解释合理的是________
A.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
B.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
C.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
D.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
(3)在实验室里,某同学取一小块金属钠做钠与水反应的实验。将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①__________,②__________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:

(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)B→D,D→E的反应类型分别为 、 。
(5)G为含六元环的化合物,写出其结构简式: 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为 。
(7)写出E→F的化学方程式: 。
(8)A的结构简式为 ,A与等物质的量的Br2进行加成反应的产物共有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的说法不正确的是
A.加热可除去Na2CO3固体中的NaHCO3
B.Na2CO3和NaHCO3二者在一定条件下可以相互转化
C.热稳定性:NaHCO3>Na2CO3
D.相同物质的量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体的质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g)![]() 2NO2(g) △ H = 113.0kJ
2NO2(g) △ H = 113.0kJ![]() mol1
mol1
2SO2(g) + O2(g)![]() 2SO3(g) △ H = 196.6kJ
2SO3(g) △ H = 196.6kJ![]() mol1
mol1
SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为_____.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(2)提高2SO2(g) + O2(g)![]() 2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是_____.②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是_____(填字母).
2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是_____.②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度

(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_____.
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com