
����Ŀ����ҵ����������β���ŷų��� SO2��NOx�ȣ����γ���������Ҫ���أ������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1��NOx�� SO2�ڿ����д�������ƽ�⣺
2NO(g) + O2(g)![]() 2NO2(g) �� H = 113.0kJ
2NO2(g) �� H = 113.0kJ![]() mol1
mol1
2SO2(g) + O2(g)![]() 2SO3(g) �� H = 196.6kJ
2SO3(g) �� H = 196.6kJ![]() mol1
mol1
SO2ͨ���ڶ��������Ĵ����£���һ�������������� SO3��
��д�� NO2�� SO2��Ӧ���Ȼ�ѧ����ʽΪ_____��
�����¶����ߣ��÷�Ӧ��ѧƽ�ⳣ���仯������_____��
��2�����2SO2(g) + O2(g)![]() 2SO3(g)��Ӧ�� SO2��ת���ʣ��Ǽ��� SO2�ŷŵ���Ч��ʩ:��T �¶�ʱ���� 1L ���ܱ������м��� 2.0mol SO2�� 1.0mol O2��5min ��Ӧ�ﵽƽ�⣬���������ת����Ϊ 50%���÷�Ӧ��ƽ�ⳣ����_____���������������£���Ӧ�ﵽƽ��ı�������������ʹ SO2��ת������ߵ���_____(����ĸ)��
2SO3(g)��Ӧ�� SO2��ת���ʣ��Ǽ��� SO2�ŷŵ���Ч��ʩ:��T �¶�ʱ���� 1L ���ܱ������м��� 2.0mol SO2�� 1.0mol O2��5min ��Ӧ�ﵽƽ�⣬���������ת����Ϊ 50%���÷�Ӧ��ƽ�ⳣ����_____���������������£���Ӧ�ﵽƽ��ı�������������ʹ SO2��ת������ߵ���_____(����ĸ)��
a.�¶Ⱥ�����������䣬���� 1.0mol He
b.�¶Ⱥ�����������䣬���� 1.0mol O2
c.��������������ʱ���������������
d.��������������ʱ�����ø�Ч����
e.��������������ʱ��������ϵ�¶�

��3����ҵ�������ȼҵ��Ʒ��������������ķ�������ͼ���ȼҵ�е�ⱥ��ʳ��ˮ��ԭ��ʾ��ͼ
������ҺA���պ���������ķ������䷴Ӧ�����ӷ���ʽ��_____��
���ú�����B����������Һ���պ���������ķ������䷴Ӧ�����ӷ���ʽ��_____��
���𰸡�NO2(g)+SO2(g)=SO3(g)+NO(g) ��H=41.8kJmol1 ��С 2 bc SO2+OH-=HSO3-����SO2+2OH-=SO32-+H2O�� SO2+Cl2+H2O=4H++SO42-+2Cl-
��������
��1����NO2��SO2��Ӧ�Ļ�ѧ����ʽΪ��NO2(g)+SO2(g)=SO3(g)+NO(g)�����ݸ�˹���ɿɵã�����-�٣�/2�ɵ�����H��
�ڶ������ȷ�Ӧ���¶����ߣ�ƽ�ⳣ�������ڷ��ȷ�Ӧ���¶����ߣ�ƽ�ⳣ����С��
��2���ٸ�������ʽ����ƽ�ⳣ����
��a.�¶Ⱥ�����������䣬����������壬ƽ�ⲻ�ƶ���ת���ʲ��䣻
b.�¶Ⱥ�����������䣬���ӷ�Ӧ��Ũ�ȣ�ƽ�������ƶ���ת��������
c.����������������൱������ѹǿ��ƽ�������ƶ���ת������ߣ�
d.����ֻ�ı䷴Ӧ���ʣ���Ӱ��ת���ʣ�
e.�÷�Ӧ����ӦΪ���ȷ�Ӧ��������ϵ�¶ȣ�ƽ�������ƶ���ת���ʱ�С��
��3����ⱥ��ʳ��ˮ��������2Cl--2e-=Cl2����������2H++2e-=H2�����ܷ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2������������BΪ��������ҺAΪ�������ơ�
2NaOH+Cl2��+H2������������BΪ��������ҺAΪ�������ơ�
��1����NO2��SO2��Ӧ�Ļ�ѧ����ʽΪ��NO2(g)+SO2(g)=SO3(g)+NO(g)�����ݸ�˹���ɣ�(��-��)/2�ã���H =![]() ( 196.6kJ
( 196.6kJ![]() mol1+113.0kJ
mol1+113.0kJ![]() mol1)=41.8kJmol1�����Ȼ�ѧ��Ӧ����ʽΪ��NO2(g)+SO2(g)=SO3(g)+NO(g) ��H=41.8kJmol1���ʴ�Ϊ��NO2(g)+SO2(g)=SO3(g)+NO(g) ��H=41.8kJmol1��
mol1)=41.8kJmol1�����Ȼ�ѧ��Ӧ����ʽΪ��NO2(g)+SO2(g)=SO3(g)+NO(g) ��H=41.8kJmol1���ʴ�Ϊ��NO2(g)+SO2(g)=SO3(g)+NO(g) ��H=41.8kJmol1��
���ɢٿ�֪���÷�Ӧ������ӦΪ���ȷ�Ӧ�����������¶ȣ�ƽ���������ƶ���ƽ�ⳣ����С���ʴ�Ϊ����С��
��2����1L�ܱ������У�5min�ڸ�����Ũ�ȷ����ı仯���£�
2SO2(g)+O2(g)![]() 2SO3(g)��
2SO3(g)��
��ʼŨ��(mol/L) 210
�仯Ũ��(mol/L) 10.51
ƽ��Ũ��(mol/L) 10.5 1
ƽ�ⳣ�� ���ʴ�Ϊ��2��
���ʴ�Ϊ��2��
��a.�¶Ⱥ�����������䣬����1.0molHe��ƽ�ⲻ�ƶ���SO2��ת���ʲ��䣬a����
b.�¶Ⱥ�����������䣬����1.0molO2��ƽ�������ƶ���SO2��ת������ߣ�b��ȷ��
c.�������������䣬����������������൱������ѹǿ��ƽ�������ƶ���SO2��ת������ߣ�c��ȷ��
d.��������������ʱ�����ø�Ч������ƽ�ⲻ�ƶ���SO2��ת���ʲ��䣬d����
e.�÷�Ӧ����ӦΪ���ȷ�Ӧ����������������ʱ��������ϵ�¶ȣ�ƽ�������ƶ���SO2��ת���ʱ�С��e���ʴ�Ϊ��bc��
��3���ٵ�ⱥ��ʳ��ˮ��������2Cl--2e-=Cl2����������2H++2e-=H2�����ܷ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2��������BΪ��������ҺAΪ�������ơ������������������Ӧ���仯ѧ��Ӧ����ʽΪ��SO2+NaOH= NaHSO3����SO2+2NaOH=Na2SO3+H2O���������ӷ�Ӧ����ʽΪ��SO2+OH-=HSO3-����SO2+2OH-=SO32-+H2O�����ʴ�Ϊ��SO2+OH-=HSO3-����SO2+2OH-=SO32-+H2O����
2NaOH+Cl2��+H2��������BΪ��������ҺAΪ�������ơ������������������Ӧ���仯ѧ��Ӧ����ʽΪ��SO2+NaOH= NaHSO3����SO2+2NaOH=Na2SO3+H2O���������ӷ�Ӧ����ʽΪ��SO2+OH-=HSO3-����SO2+2OH-=SO32-+H2O�����ʴ�Ϊ��SO2+OH-=HSO3-����SO2+2OH-=SO32-+H2O����
������BΪ����������Һ�����������������ԭ��Ӧ������������ᣬ�仯ѧ��Ӧ����ʽΪ��SO2+Cl2+2H2O=H2SO4+2HCl�������ӷ�Ӧ����ʽΪ��SO2+Cl2+H2O=4H++SO42-+2Cl-���ʴ�Ϊ��SO2+Cl2+H2O=4H++SO42-+2Cl-��


 ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų������������NOx����CO2��CO��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
��.������
��֪��H2��ȼ����Ϊ285.8kJ/mol
N2��g��+2O2��g��=2NO2��g����H=+133kJ/mol
H2O��g��=H2O��l����H=-44kJ/mol
��1�����������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ__________________________��
��.��̼��
��2����2L�ܱ������м���2molCO2��6molH2�����ʵ��Ĵ��������£�������Ӧ��CO2��g��+3H2��g��![]() CH3OH��l��+H2O��l����
CH3OH��l��+H2O��l����
����������˵���˷�Ӧ�ﵽƽ��״̬����__________��
A.��������ƽ��ʽ�����ֲ���
B.CO2��H2������������ֲ��䣻
C.CO2��H2��ת�������
D.���������ܶȱ��ֲ���
E.1molCO2���ɵ�ͬʱ��3molH��H������
��3����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO��������ӦCO��g��+2H2��g��![]() CH3OH��g����Ӧ�ﵽƽ��ʱCH3OH�����������V%����n��H2��/n��CO���Ĺ�ϵ��ͼ1��ʾ��
CH3OH��g����Ӧ�ﵽƽ��ʱCH3OH�����������V%����n��H2��/n��CO���Ĺ�ϵ��ͼ1��ʾ��
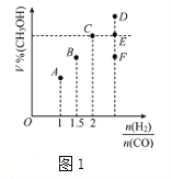

�ٵ���ʼn��H2��/n��CO��=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V��H2��=__________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ����������������С����������������
�ڵ���ʼn��H2��/n��CO��=3.5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ1�е�___________�㣨ѡ����D������E������F����
��������
��ͼ2��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ������ڹ�ũҵ�������ճ����������Ź㷺����;��
(1)��ҵ���������Ʊ�Ư�ۣ�ij�о�С����������װ���Ʊ�Ư�ۡ�

��Ư�۵���Ч�ɷ���_____________���ѧʽ����Ư�۷����ڿ�����һ��ʱ����ʧЧ��ԭ���ǣ�д���йط�Ӧ�Ļ�ѧ����ʽ��________________________��
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��װ��B���Լ�aΪ_________��������________________________________��
(2)ClO2����������ˮ��������ľ��ֽ����Ư�ס���֪��NaCl��3H2O![]() NaClO3��3H2����2NaClO3��4HCl=2ClO2����Cl2����2NaCl��2H2O���й����ʵ��ۡ��е����±���
NaClO3��3H2����2NaClO3��4HCl=2ClO2����Cl2����2NaCl��2H2O���й����ʵ��ۡ��е����±���
���� | �۵�/�� | �е�/�� |
ClO2 | ��59 | 11 |
Cl2 | ��107 | ��34.6 |
ClO2����������ʾ��ͼ���£�

������ÿ����1molClO2��������ٲ���X����________ mol����ClO2�������з����ClO2�ɲ��õķ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������pH��11��X��Y���ּ���Һ��5 mL���ֱ�ϡ����500 mL����pH����Һ���(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)

A. ϡ�ͺ�X��Һ��ˮ�ĵ���̶ȱ�Y��Һ��ˮ����̶�С
B. ��XΪǿ���a��9
C. ��X��Y���������a��ֵһ��С��9
D. ��ȫ�к�X��Y����Һʱ������ͬŨ��ϡ��������V(X)��V(Y)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�(����ΪCu2O/ZnO)��CO(g)��2H2(g)![]() CH3OH(g)��������������������⣺
CH3OH(g)��������������������⣺

(1)��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��__________�������¶ȣ�Kֵ________(�������С�����䡱)��ƽ����__________�����ƶ���
(2)��500 �棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)____________________�����ú���Ӧ��ĸ��ʽ�ӱ�ʾ��
(3)�������������������£�������E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����________(��ѡ����ĸ)��
A��������Ũ�ȼ�С B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
C���״������ʵ������� D������ƽ��ʱn(H2)/n(CH3OH)����
(4)���о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬ԭ����________(�û�ѧ����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£������������ܱ������У��п��淴ӦX(s)+2Y(g) ![]() 2Z(g) ��H<0������˵��������ȷ����
2Z(g) ��H<0������˵��������ȷ����
A. 0.2molX��0.4molY��ַ�Ӧ��Z�����ʵ������ܻ�ﵽ0.35mol
B. ���������Ƴ����ַ�Ӧ��X��������Ӧ���ʽ��½�
C. ����H����ʱ����Ӧ���ﵽƽ��
D. ��Ӧ��ϵ�м���ͨ������Y���壬X�п��ܱ���Ӧ��ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶�ʱ��N2��H2��Ӧ�����������仯��������ͼ������a��ʾ��ʹ�ô���ʱ�������仯���ߣ�b��ʾʹ�ô���ʱ�������仯���ߡ�����������ȷ����
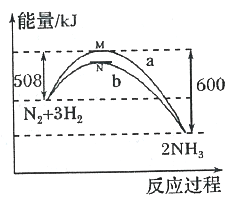
A. ״̬M��N����ʾ2molN(g)+6mol H(g)
B. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H=-92kJ��mol-l
2NH3 ��H=-92kJ��mol-l
C. ʹ�ô����������˷�Ӧ�����������������������˷�Ӧ�ų�������
D. ʹ�ô����������ܸı䷴Ӧ�ġ�H
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=a��ij�������Һ�У�������֧���Ե缫��ֱͨ����һ��ʱ�����Һ��pH��a����õ���ʿ�����
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
�� CH3OH(g)��H2O(g)===CO2(g)��3H2(g)����H����49.0 kJ/mol
�� CH3OH(g)��![]() O2(g)===CO2(g)��2H2(g)����H����192.9 kJ/mol
O2(g)===CO2(g)��2H2(g)����H����192.9 kJ/mol
����˵����ȷ���� �� ��
A. CH3OH��ȼ����Ϊ192.9 kJ/mol
B. ��Ӧ���е������仯��ͼ��ʾ
C. CH3OHת���H2�Ĺ���һ��Ҫ��������
D. ��������֪��Ӧ��CH3OH(l)��![]() O2(g)===CO2(g)��2H2(g)����H>��192.9 kJ/mol
O2(g)===CO2(g)��2H2(g)����H>��192.9 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com