
����Ŀ���ס�����ͬѧ�ֱ�����ͼ��ʾװ�òⶨ�����������ĺ��������õ��ɼм�ס��,��ȼ��,����ƿ�в�����ƿ��������Ϩ����ȴ��,���ɼ�,�۲��ƿ��ˮ��ı仯���:

��1������ʵ������з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��2����ͬѧʵ���й�ƿ��ˮ����������С��ƿ�ڿ��������![]() ,��ͬѧʵ���й�ƿ��ˮ���������Դ���ƿ�ڿ��������
,��ͬѧʵ���й�ƿ��ˮ���������Դ���ƿ�ڿ��������![]() �����ж�������������ͺ�������________
�����ж�������������ͺ�������________
A.��ͬѧ����ʹ�õ��Ƶ������㣬ƿ������û��������
B.��ͬѧ����δ����ƿ������Ϩ����ȴ������������ƿ��
C.��ͬѧ����û�мн����ɼУ���ȼ��ʱƿ�ڲ��ֿ������ȴӵ����ݳ�
D.��ͬѧ���ܲ���ȼ�ճ�̫��������ƿ��֮ǰƿ�ڲ��ֿ��������ݳ�
��3����ʵ������,ijͬѧȡһС�������������ˮ��Ӧ��ʵ�顣����Ͷ��ˮ�к�,���ۻ���һ��С��,������һ�������ܵó��Ľ����Ǣ�__________,��__________,
���𰸡�2Na+O2![]() Na2O2 ABCD ����ˮ��Ӧ�ų����� �Ƶ��۵��
Na2O2 ABCD ����ˮ��Ӧ�ų����� �Ƶ��۵��
��������
(1)���ڼ�����������������Ӧ���ɹ������ƣ��ݴ�д����ѧ��Ӧ����ʽ���ɣ�ע��������
(2)A�����Ƶ������㣬���������IJ��꣬��ɽ�ˮ�����������ݻ�������
B����ƿ��δ��������Ϩ����ȴ��ƿ����������������Ŀ��������ƿ�ڣ�ʹ����õ����䣻
C�������ɼ�δ�н�����ȼ��ʱ��ƿ���������ͣ�ʹ��������ӵ��ܿ��ݳ���
D��������ȼ�ճ�̫������ȼ��ʱ��ƿ���������ͣ�������ƿ��ǰ��ƿ�ڲ��������ƿ���ݳ���
(3)�������ۻ���һ��С���֪��Ӧ�ų��������Ƶ��۵�͡�
(1)���ڼ�����������������Ӧ���ɹ������ƣ���ѧ��Ӧ����ʽΪ: 2Na+O2![]() Na2O2��
Na2O2��
(2)A���Ƶ������㣬ƿ������û�������꣬��������ʣ�࣬��ƿ��ˮ�������߶ȴﲻ����ѡ��A��ȷ��
B��ƿ��ĩ��������Ϩ����ȴʱ����������ƿ�ڣ�����ƿ��ѹǿ����ˮ�������߶ȴﲻ����ѡ��B��ȷ��
C��û�н����ɼУ���ȼ��ʱƿ�ڲ��ֿ������ȴӵ����ݳ�������ƿ��ѹǿ��С��ˮ�������߶ȳ�����ѡ��C��ȷ��
D������ȼ�ճ�̫��������ƿ��֮ǰ��ƿ�ڲ��ֿ��������ݳ�������ƿ��ѹǿ��С��ˮ�������߶ȳ�����ѡ��D��ȷ��
��ѡABCD��
(3)����Ͷ��ˮ�к����ۻ���һ��С������һ�������ܵó��Ľ�����������ˮ��Ӧ�ų����������Ƶ��۵�͡�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦNH4Cl+NaNO2![]() NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
A. ������Ϊ18����ԭ�ӣ�![]()
B. N2�Ľṹʽ��N=N
C. Na+�Ľṹʾ��ͼ�� 
D. H2O�ĵ���ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������� NO2 �� O2 ���Թܵ�����ˮ���У���ַ�Ӧ��ʣ���������Ϊԭ������������![]() ����ԭ��������� NO2 ��O2 �����֮�ȿ����ǣ� ��
����ԭ��������� NO2 ��O2 �����֮�ȿ����ǣ� ��
��8��1 ��7��3 ��7��1 ��4��1
A.�٢�B.�٢�
C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ�������
A.![]() �����ᷴӦ:
�����ᷴӦ:![]()
B.![]() ���ڹ���NaOH��Һ: Al2O3+2OH-=2AlO2-+H2O
���ڹ���NaOH��Һ: Al2O3+2OH-=2AlO2-+H2O
C.����������������Һ: 2Al+2OH-+2H2O=2AlO2-+3H2��
D.![]() ����NaOH��Һ:
����NaOH��Һ:![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų������������NOx����CO2��CO��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
��.������
��֪��H2��ȼ����Ϊ285.8kJ/mol
N2��g��+2O2��g��=2NO2��g����H=+133kJ/mol
H2O��g��=H2O��l����H=-44kJ/mol
��1�����������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ__________________________��
��.��̼��
��2����2L�ܱ������м���2molCO2��6molH2�����ʵ��Ĵ��������£�������Ӧ��CO2��g��+3H2��g��![]() CH3OH��l��+H2O��l����
CH3OH��l��+H2O��l����
����������˵���˷�Ӧ�ﵽƽ��״̬����__________��
A.��������ƽ��ʽ�����ֲ���
B.CO2��H2������������ֲ��䣻
C.CO2��H2��ת�������
D.���������ܶȱ��ֲ���
E.1molCO2���ɵ�ͬʱ��3molH��H������
��3����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO��������ӦCO��g��+2H2��g��![]() CH3OH��g����Ӧ�ﵽƽ��ʱCH3OH�����������V%����n��H2��/n��CO���Ĺ�ϵ��ͼ1��ʾ��
CH3OH��g����Ӧ�ﵽƽ��ʱCH3OH�����������V%����n��H2��/n��CO���Ĺ�ϵ��ͼ1��ʾ��
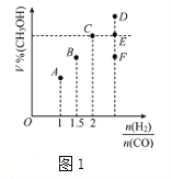

�ٵ���ʼn��H2��/n��CO��=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V��H2��=__________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ����������������С����������������
�ڵ���ʼn��H2��/n��CO��=3.5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ1�е�___________�㣨ѡ����D������E������F����
��������
��ͼ2��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����ѧ��ѧ�г������������ʣ�����֮����ת����ϵ����(���ַ�Ӧ������������ȥ)��
![]()
![]()
![]()
![]()
![]()
(1)��A��һ�ֽ�����C�ǵ���ɫ���壬��B�Ļ�ѧʽΪ________________��A��C��Ӧ�Ļ�ѧ����ʽΪ________________��
(2)��A��һ�ַǽ������䳣������Ϊ��ɫ���壬C������Ҫ���������壬��C�ķ���ʽΪ_______��B��C��Ӧ�Ļ�ѧ����ʽΪ____________________________��A��C�Ƿ��ܷ�Ӧ��______(������������������)�����ܣ�д����Ӧ�Ļ�ѧ����ʽ��____________________(�����ܣ��˿ղ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ����(17��̼ԭ�����ϵ�Һ̬���������)�ķֽ�ʵ��װ����ͼ��ʾ(���������Ѻ���)���Թܢ��м���ʯ���ͺ�������(��ʯ���ֽ�)���Թܢڷ�����ˮ�У��Թܢ��м�����ˮ��ʵ�������Թܢ��м���һ��ʱ����Կ����Թ���Һ����ڣ��Թܢ���������Һ�����ᣬ�ŵ����͵���ζ����Һ���еμӼ��θ������������Һ��ɫ��ȥ������ʵ������ش��������⣺

(1)װ��A��������________
(2)�Թܢ��з�������Ҫ��Ӧ�У�C8H18![]() C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 ![]() C8H18+C9H18����ɽ�һ���ѽ⣬���õ�����������⣬�����Եõ��������л�����ǵĽṹ��ʽΪ________��________���������л����Ϻ���һ�������¿ɾۺϳɸ߷��ӻ�����䷴Ӧ��������________��Ӧ������ܽṹΪ________(����ĸ���𰸿��ܲ�ֹһ������ͬ)
C8H18+C9H18����ɽ�һ���ѽ⣬���õ�����������⣬�����Եõ��������л�����ǵĽṹ��ʽΪ________��________���������л����Ϻ���һ�������¿ɾۺϳɸ߷��ӻ�����䷴Ӧ��������________��Ӧ������ܽṹΪ________(����ĸ���𰸿��ܲ�ֹһ������ͬ)
A��![]() B��
B��![]()
C��![]() D��
D��![]()
(3)д���Թܢ��з�Ӧ������һ����ѧ����ʽ________________��
(4)�Թܢ��е�����Һ��������________(�����)
�ټ��� ����ϩ ��Һ̬���� ��Һ̬ϩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2���йظõ�ص�˵����ȷ���ǣ� ��
Cd(OH)2+2Ni(OH)2���йظõ�ص�˵����ȷ���ǣ� ��
A. �ŵ�ʱ����������Һ�ļ��Բ���
B. �������ǻ�ѧ��ת��Ϊ���ܵĹ���
C. ���ʱ������Ӧ��Ni(OH)2��e��+ OH��=NiOOH + H2O
D. �ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£������������ܱ������У��п��淴ӦX(s)+2Y(g) ![]() 2Z(g) ��H<0������˵��������ȷ����
2Z(g) ��H<0������˵��������ȷ����
A. 0.2molX��0.4molY��ַ�Ӧ��Z�����ʵ������ܻ�ﵽ0.35mol
B. ���������Ƴ����ַ�Ӧ��X��������Ӧ���ʽ��½�
C. ����H����ʱ����Ӧ���ﵽƽ��
D. ��Ӧ��ϵ�м���ͨ������Y���壬X�п��ܱ���Ӧ��ȫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com