
【题目】关于下列装置说法正确的是

A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
【答案】A
【解析】
A、活泼金属做负极被损耗,阴离子向负极移动;
B、电解饱和食盐水时,氢离子在阴极放电,阴极区附近溶液的pH增大;
C、精炼铜时,粗铜作阳极,与电源的正极相连;
D、活泼金属做负极被损耗,不活泼金属被保护。
A项、在装置①中锌是负极,铜是正极,Cl-移向负极ZnSO4溶液,故A正确;
B项、装置②中b电极与电源正极相连,作阳极,Cl-在阳极放电,a极才是H+放电,所以装置②工作一段时间后,a极附近溶液的pH增大,故B错误;
C项、用装置③精炼铜时,粗铜作阳极,与电源的正极相连,所以用装置③精炼铜时,d极为粗铜,故C错误;
D项、装置④中锌比铁活泼,锌是负极失电子,负极反应式为Zn-2e-=Zn2+,装置中没有Fe2+生成,故D错误。


科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中,x轴表示实验时流入正极的电子的物质的量, 下列说法中不正确的是
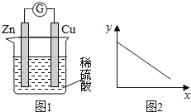
A.y轴可表示锌片的质量
B.y轴可表示溶液中c(H+)
C.若导线上转移2mol电子,则有2molH2生成
D.溶液中的阳离子向正极移动,阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,V mL不饱和NaNO3溶液a g,蒸发掉b g水或加入b g NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列各量的计算结果正确的是( )
A. 该温度下NaNO3的溶解度为50 g
B. 原不饱和溶液的密度为![]() g·mL-1
g·mL-1
C. 原不饱和溶液中NaNO3的质量分数为![]() %
%
D. 原不饱和溶液中NaNO3的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. 图2中Y电极为阴极
B. 图2中总反应的化学方程式为:2AlCl3+6H2O2![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
C. 图1中电解质溶液的pH增大
D. 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. ![]() 在
在![]() 中燃烧可以生成
中燃烧可以生成![]() 和
和![]() 的混合物
的混合物
B. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C. 相同温度下,![]() 在同浓度的
在同浓度的![]() 和
和![]() 溶液中的溶解度不相同
溶液中的溶解度不相同
D. 电解精炼铜时,同一时间内阴极析出铜的质量比阳极溶解铜的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
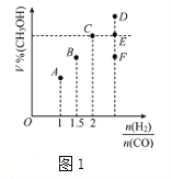

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯化合物在工农业生产和日常生活中有着广泛的用途。
(1)工业上用氯气制备漂白粉,某研究小组利用下列装置制备漂白粉。

①漂白粉的有效成分是_____________(填化学式)。漂白粉放置在空气中一段时间后会失效,原因是(写出有关反应的化学方程式)________________________。
②装置A中发生反应的化学方程式为___________________________________。
③装置B中试剂a为_________,作用是________________________________。
(2)ClO2常用于自来水的消毒、木质纸浆的漂白。已知:NaCl+3H2O![]() NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
物质 | 熔点/℃ | 沸点/℃ |
ClO2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图如下:

理论上每生成1molClO2,外界至少补充X气体________ mol。从ClO2发生器中分离出ClO2可采用的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com