
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
【答案】A
【解析】
对于反应4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g),用不同物质表示其反应速率,数值不同但意义相同,所以比较反应速率要转化为同种物质的反应速率来比较大小,利用反应速率之比等于化学计量数之比来分析。
4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g)
A.v(NH3)=0.6molL -1min -1;
B.v(O2)=0.4molL -1min -1,则v(NH3)=0.4molL -1min -1×![]() =0.53 molL -1min -1;
=0.53 molL -1min -1;
C.v(N2)=0.2molL -1min -1,则v(NH3)=0.2 molL -1min -1×2=0.4 molL -1min -1;
D.v(H2O)=0.3 molL -1min -1,,则v(NH3)=0.3molL -1min -1×![]() =0.2 molL -1min -1;
=0.2 molL -1min -1;
显然A表示的该反应的反应速率最大,
故选A。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下表是25℃时三种弱酸的电离平衡常数:
化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因____________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为____________。
(3)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为________________,解释混合溶液呈碱性的原因_________________________________。
(4)写出NaA溶液中通少量CO2的离子方程式_______________________________________。
(5)某同学用Na2CO3和NaHCO3溶液进行如下图所示实验:

① 充分反应后a试管中大量存在的离子是_______________________________________。
② 用离子方程式表示b试管中发生的反应_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为______________,仪器b的作用是______________。
(2)装置A中生成NaClO2的离子方程式为____________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶、过滤 _____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)B中现象为____________________________________ 。
(5)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:
(1)能使石蕊试液变色的有______种.
(2)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是______
(3)不同情况下与氢氧化钠反应能生成两种盐的是______.
II、有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为:________. |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________. |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况). | (3)用结构简式表示A中含有的官能团:________、________. |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子. |
(5)综上所述,A的结构简式________. | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。用此装置和表中提供的物质能完成相关实验的是

选项 | a中物质 | b中物质 | c中的气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硝酸 | Cu | NO | H2O |
C | 硫酸 | Na2CO3 | CO2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成物的总能量大于反应物的总能量的是( )
A. 铝粉与氧化铁的反应B. 氯化铵与Ba(OH)2·8H2O反应
C. 锌片与稀硫酸反应D. 钠与冷水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学在实验室用卤块制备少量Mg(ClO3)2·6H2O,其流程如图所示:
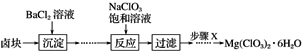
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)的变化曲线如图所示。

③形成氢氧化物沉淀时,不同离子对应溶液的pH如下:Fe2+开始沉淀的pH为5.8,完全沉淀的pH为8.8;Fe3+开始沉淀的pH为1.1,完全沉淀的pH为3.2;Mg2+开始沉淀的pH为8.2,完全沉淀的pH为11。
④可选用的试剂:H2O2、稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
(1)步骤X包含的操作为___________、 ___________、____________、过滤洗涤并干燥。
(2)加入BaCl2溶液沉淀后需经过两步实验步骤才进行下步反应,请写出这两步实验步骤:
①________________________________________________________________________;
② _______________________________________________________________________;
(3)加入NaClO3饱和溶液发生反应的化学方程式为_______________________________。
(4)将Mg(ClO3)2加入到含有KSCN的FeSO4溶液中立即出现红色,写出相关反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com