
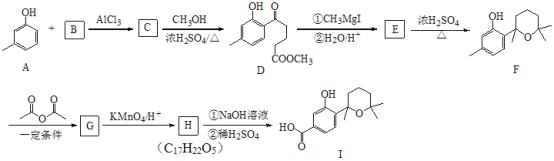
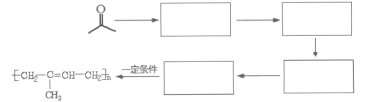
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,I是一种萜类化合物,它的合成路线如图所示:
已知:
Ⅰ.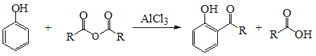
Ⅱ.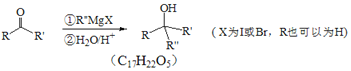
Ⅲ.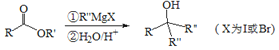
回答下列问题:
(1)A的名称是________,A+B→C的反应类型是___________;
(2)F的分子式_______________,其分子中所含官能团的名称是____________;
(3)H→I第一步的化学反应方程式_________________;
(4)B含有一个环状结构,其结构简式为_________________;
它的同分异构体有多种,其中符合下列条件的有___________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与NaHCO3反应生成CO2
(5)流程中设计F→G这步反应的作用_________________;
(6)F与(CH3CO)2O按物质的量1∶1发生反应生成G的化学方程式为____________;
(7)请以CH3COCH3、CH3CH2MgBr为原料,结合题目所给信息,制备高分子化合物 的流程。
的流程。
例如:原料![]() ……目标化合物
……目标化合物
___________________。
【答案】间甲基苯酚或3-甲基苯酚 取代反应 C15H22O2 羟基 醚键 
 8 保护酚羟基不被氧化
8 保护酚羟基不被氧化 

【解析】
由D的结构简式逆推可知C为 ,对比A、C的结构,结合信息I中取代反应,可推知B为
,对比A、C的结构,结合信息I中取代反应,可推知B为 。结合反应条件与信息II、III,可知E为
。结合反应条件与信息II、III,可知E为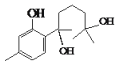 。对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为
。对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为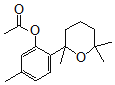 ,H为
,H为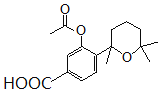 。据此分析解答。
。据此分析解答。
(1)A(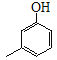 )的名称为间甲基苯酚或3-甲基苯酚;根据上述分析,A+B→C的反应类型是取代反应,故答案为:间甲基苯酚或3-甲基苯酚;取代反应;
)的名称为间甲基苯酚或3-甲基苯酚;根据上述分析,A+B→C的反应类型是取代反应,故答案为:间甲基苯酚或3-甲基苯酚;取代反应;
(2)F(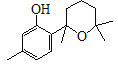 )的分子式为C15H22O2,结构中所含官能团有羟基和醚键,故答案为:羟基、醚键;
)的分子式为C15H22O2,结构中所含官能团有羟基和醚键,故答案为:羟基、醚键;
(3)H( )与氢氧化钠溶液反应时,酯基水解生成的酚羟基也能与氢氧化钠反应,因此H→I第一步的化学反应方程式为
)与氢氧化钠溶液反应时,酯基水解生成的酚羟基也能与氢氧化钠反应,因此H→I第一步的化学反应方程式为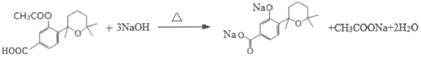 ,故答案为:
,故答案为: ;
;
(4)根据上述分析,B含有一个环状结构,B的结构简式为 ,分子式为C5H6O3,不饱和度=
,分子式为C5H6O3,不饱和度=![]() =3,它的同分异构体有多种,①不含有环状结构,②能发生银镜反应,说明含有醛基,③能与NaHCO3反应生成CO2,说明含有羧基,因此结构中还含有1个碳碳双键,符合条件的结构中含有—C—C=C—,根据定一移二的方法分别确定羧基和醛基的位置,共有8种结构,故答案为:
=3,它的同分异构体有多种,①不含有环状结构,②能发生银镜反应,说明含有醛基,③能与NaHCO3反应生成CO2,说明含有羧基,因此结构中还含有1个碳碳双键,符合条件的结构中含有—C—C=C—,根据定一移二的方法分别确定羧基和醛基的位置,共有8种结构,故答案为: ;8;
;8;
(5)对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,流程中设计F→G这步反应的作用为,故答案为:保护酚羟基不被氧化;
(6)F( )与(CH3CO)2O按物质的量1:1发生反应生成G的化学方程式为
)与(CH3CO)2O按物质的量1:1发生反应生成G的化学方程式为 ,故答案为:
,故答案为: ;
;
(7)以CH3COCH3、CH3CH2MgBr为原料,制备高分子化合物 。要制备
。要制备 需要先合成CH2=C(CH3)-CH=CH2,根据信息Ⅱ,CH3COCH3经过①CH3CH2MgBr、②H2O/H+得到
需要先合成CH2=C(CH3)-CH=CH2,根据信息Ⅱ,CH3COCH3经过①CH3CH2MgBr、②H2O/H+得到 ,
, 消去羟基可以得到CH3-C(CH3)=CH-CH3,经过CH3-C(CH3)=CH-CH3与溴加成再消去溴原子即可得到,CH2=C(CH3)-CH=CH2,CH2=C(CH3)-CH=CH2发生聚合反应即可生成目标产物,因此合成路线为CH3COCH3
消去羟基可以得到CH3-C(CH3)=CH-CH3,经过CH3-C(CH3)=CH-CH3与溴加成再消去溴原子即可得到,CH2=C(CH3)-CH=CH2,CH2=C(CH3)-CH=CH2发生聚合反应即可生成目标产物,因此合成路线为CH3COCH3![]()

![]() CH3-C(CH3)=CH-CH3
CH3-C(CH3)=CH-CH3![]() CH3-CBr(CH3)-CHBr-CH3
CH3-CBr(CH3)-CHBr-CH3![]() CH2=C(CH3)-CH=CH2
CH2=C(CH3)-CH=CH2![]()
 ,故答案为:
,故答案为:![]()

![]() CH3-C(CH3)=CH-CH3
CH3-C(CH3)=CH-CH3![]() CH3-CBr(CH3)-CHBr-CH3
CH3-CBr(CH3)-CHBr-CH3![]() CH2=C(CH3)-CH=CH2。
CH2=C(CH3)-CH=CH2。


科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如装置简图:

请你参与分析讨论:
(1)图中仪器B的名称:____________________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________________________。
(4)C中液体产物颜色为___________________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知: +
+![]() →2ROH+
→2ROH+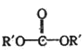
回答下列问题:
(1) B的分子式是__________ 。若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为__________。
(2) C中含有的官能团名称是_______________。⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:___________________________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:______________________。
i .含有苯环和![]() 结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备
的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备 的合成流程图:_____________________________。
的合成流程图:_____________________________。
合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. 图2中Y电极为阴极
B. 图2中总反应的化学方程式为:2AlCl3+6H2O2![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
C. 图1中电解质溶液的pH增大
D. 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。
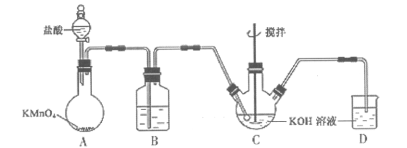
(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
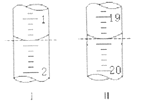
①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式错误的是
A.![]() 与盐酸反应:
与盐酸反应:![]()
B.![]() 溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
C.铝溶于氢氧化钠溶液: 2Al+2OH-+2H2O=2AlO2-+3H2↑
D.![]() 溶于NaOH溶液:
溶于NaOH溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com