
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬ФЪ 2 L әгИЭГЬұХИЭЖчЦР 3 ЦЦОпЦКјдҪшРР·ҙУҰЈ¬XЎўYЎўZ өДОпЦКөДБҝЛжКұјдөДұд»ҜЗъПЯИзНјЛщКҫЈ¬·ҙУҰФЪ t1 min КұҙпөҪЖҪәвЎЈ

ЈЁ1Ј©ЗлРҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪЈә_____ЎЈ
ЈЁ2Ј©ИфЙПКц·ҙУҰЦРXЎўYЎўZ ·ЦұрОӘ NH3ЎўH2ЎўN2Ј¬ФЪҙЛ t1 min КұјдДЪЈ¬УГH2 ұнКҫёГ·ҙУҰөДЖҪҫщЛЩВК vЈЁH2Ј©ОӘ_____ЎЈ
ЈЁ3Ј©ІрҝӘ 1mol №ІјЫјьЛщРиОьКХөДДЬБҝИзПВұнЈә
№ІјЫјь | HЈӯH | NЎФN | NЈӯH |
ОьКХөДДЬБҝ/kJ | 436 | 946 | 391 |
1mol N2 НкИ«·ҙУҰОӘNH3_____ЈЁМоЈәОьКХ»т·ЕіцЈ©_____kJ ДЬБҝЎЈКВКөЙПЈ¬Ҫ« 1molN2 әН3molH2 ·ЕФЪ·ҙУҰИЭЖчЦРЈ¬К№ЛьГЗід·Ц·ҙУҰЈ¬·ҙУҰөДИИБҝұд»ҜЧЬРЎУЪјЖЛгЦөЈ¬ФӯТтКЗ_________ЎЈ
ЈЁ4Ј©ПВБРРрКцДЬЕР¶ПёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬өДКЗ_____ЈЁМоЧЦДёҙъәЕЈ©ЎЈ
A ИЭЖчДЪёчЖшМеЧй·ЦөДЦКБҝ·ЦКэІ»ФЩ·ўЙъёДұд
B Хэ·ҙУҰЛЩВКУлДж·ҙУҰЛЩВКПаөИ
C ИЭЖчДЪЖшМеөДГЬ¶ИІ»ФЩ·ўЙъёДұд
D »мәПЖшМеөДЖҪҫщПа¶Ф·ЦЧУЦКБҝІ»ФЩ·ўЙъёДұд
Ўҫҙр°ёЎҝ2X3YЈ«Z ![]() ·Еіц 92 ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬ід·Ц·ҙУҰөДЧоЦХҪб№ыКЗҙпөҪЧоҙуПЮ¶ИЈ¬јҙ»ҜС§ЖҪәвЧҙМ¬Ј¬ТтҙЛ·ЕіцөДИИБҝЧЬКЗРЎУЪАнВЫјЖЛгЦө ABD
·Еіц 92 ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬ід·Ц·ҙУҰөДЧоЦХҪб№ыКЗҙпөҪЧоҙуПЮ¶ИЈ¬јҙ»ҜС§ЖҪәвЧҙМ¬Ј¬ТтҙЛ·ЕіцөДИИБҝЧЬКЗРЎУЪАнВЫјЖЛгЦө ABD
ЎҫҪвОцЎҝ
ЈЁ1Ј©УЙНј·ЦОцЈ¬XөДОпЦКөДБҝјхЙЩЈ¬YЎўZөДОпЦКөДБҝФц¶аЈ¬ЛщТФXКЗ·ҙУҰОпЈ¬YЎўZКЗЙъіЙОпЎЈ
ЈЁ2Ј©ИфЙПКц·ҙУҰЦРXЎўYЎўZ·ЦұрОӘNH3ЎўH2ЎўN2Ј¬ФЪt1minДЪЈ¬ЗвЖшЙъіЙөДОпЦКөДБҝОӘ1.2molЈ¬УГ№«КҪЈә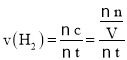 јЖЛгЎЈ
јЖЛгЎЈ
ЈЁ3Ј©ФЪ»ҜС§·ҙУҰЦРЈ¬»ҜС§јь¶ПБСОьКХДЬБҝЈ¬РОіЙРВ»ҜС§јь·ЕіцДЬБҝЈ¬ёщҫЭ·ҪіМКҪјЖЛг·ЦұрОьКХәН·ЕіцөДДЬБҝЈ¬ТФҙЛјЖЛг·ҙУҰИИІўЕР¶ПОьИИ»№КЗ·ЕИИЎЈ
ЈЁ4Ј©ҝЙДж·ҙУҰҙпөҪЖҪәвөДЦШТӘМШХчКЗХэДж·ҙУҰЛЩВКПаөИЗТІ»ОӘБгЎЈ
ЈЁ1Ј©УЙНјПуҝЙТФҝҙіцЈ¬XөДОпЦКөДБҝЦрҪҘјхЙЩЈ¬ФтXОӘ·ҙУҰОпЈ¬YЎўZөДОпЦКөДБҝЦрҪҘФц¶аЈ¬ФтYЎўZОӘЙъіЙОпЈ¬өұ·ҙУҰөҪҙпt1min КұЈ¬Ўчn(X)ЈҪ0.8molЈ¬Ўчn(Y)ЈҪ1.2molЈ¬Ўчn(Z)ЈҪ0.4molЈ¬ФЪ»ҜС§·ҙУҰЦРЈ¬ёчОпЦКөДОпЦКөДБҝөДұд»ҜЦөУл»ҜС§јЖБҝКэіКХэұИЈ¬ФтЎчn(X)ЈәЎчn(Y)ЈәЎчn(Z)ЈҪ2Јә3Јә1Ј¬ЛщТФ·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә2X3YЈ«ZЈ¬№Кҙр°ёОӘЈә2X3YЈ«ZЎЈ
ЈЁ2Ј©ИфЙПКц·ҙУҰЦРXЎўYЎўZ·ЦұрОӘNH3ЎўH2ЎўN2Ј¬ФЪt1minДЪЈ¬ЗвЖшЙъіЙөДОпЦКөДБҝОӘ1.2molЈ¬УГH2ұнКҫ·ҙУҰөДЖҪҫщЛЩВКОӘЈә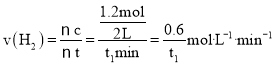 Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә![]() ЎЈ
ЎЈ
ЈЁ3Ј©·ҙУҰ![]() Ј¬1molN2НкИ«·ҙУҰОӘNH3Ј¬¶ПБС3molHHјьЈ¬1molN
Ј¬1molN2НкИ«·ҙУҰОӘNH3Ј¬¶ПБС3molHHјьЈ¬1molN![]() NјьЈ¬№ІОьКХөДДЬБҝОӘЈә3ЎБ436kJ+946kJ=2254kJЈ¬ЙъіЙ2molNH3Ј¬№ІРОіЙ6molNHјьЈ¬·ЕіцөДДЬБҝОӘЈә6ЎБ391kJ=2346kJЈ¬ОьКХөДДЬБҝЙЩЈ¬·ЕіцөДДЬБҝ¶аЈ¬ёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬·ЕіцөДИИБҝОӘЈә2346kJ2254kJ=92kJЈ»ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬І»ДЬНкИ«ЧӘ»ҜЈ¬Ҫ«1molN2әН3molH2·ЕФЪ·ҙУҰИЭЖчЦРЈ¬К№ЛьГЗід·Ц·ҙУҰЈ¬ЙъіЙNH3өДРЎУЪ2molЈ¬·ЕіцөДИИБҝРЎУЪ92kJЈ¬№Кҙр°ёОӘЈә·ЕіцЈ»92Ј»ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬ід·Ц·ҙУҰөДЧоЦХҪб№ыКЗҙпөҪЧоҙуПЮ¶ИЈ¬јҙ»ҜС§ЖҪәвЧҙМ¬Ј¬ТтҙЛ·ЕіцөДИИБҝЧЬКЗРЎУЪАнВЫјЖЛгЦөЎЈ
NјьЈ¬№ІОьКХөДДЬБҝОӘЈә3ЎБ436kJ+946kJ=2254kJЈ¬ЙъіЙ2molNH3Ј¬№ІРОіЙ6molNHјьЈ¬·ЕіцөДДЬБҝОӘЈә6ЎБ391kJ=2346kJЈ¬ОьКХөДДЬБҝЙЩЈ¬·ЕіцөДДЬБҝ¶аЈ¬ёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬·ЕіцөДИИБҝОӘЈә2346kJ2254kJ=92kJЈ»ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬І»ДЬНкИ«ЧӘ»ҜЈ¬Ҫ«1molN2әН3molH2·ЕФЪ·ҙУҰИЭЖчЦРЈ¬К№ЛьГЗід·Ц·ҙУҰЈ¬ЙъіЙNH3өДРЎУЪ2molЈ¬·ЕіцөДИИБҝРЎУЪ92kJЈ¬№Кҙр°ёОӘЈә·ЕіцЈ»92Ј»ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬ід·Ц·ҙУҰөДЧоЦХҪб№ыКЗҙпөҪЧоҙуПЮ¶ИЈ¬јҙ»ҜС§ЖҪәвЧҙМ¬Ј¬ТтҙЛ·ЕіцөДИИБҝЧЬКЗРЎУЪАнВЫјЖЛгЦөЎЈ
ЈЁ4Ј©AЈ®ИЭЖчДЪёчЖшМеЧй·ЦөДЦКБҝ·ЦКэІ»ФЩ·ўЙъёДұдЈ¬ЛөГчёчОпЦКөДБҝІ»ұдЈ¬·ҙУҰҙпЖҪәвЧҙМ¬Ј¬AХэИ·Ј»
BЈ®ФЪҝЙДж·ҙУҰЦРЈ¬Хэ·ҙУҰЛЩВКУлДж·ҙУҰЛЩВКПаөИЗТІ»ОӘБгКұЈ¬·ҙУҰҙпЖҪәвЧҙМ¬Ј¬BХэИ·Ј»
CЈ®ёщҫЭЦКБҝКШәг¶ЁВЙЈ¬·ҙУҰЗ°әуИЭЖчДЪЖшМеөДЧЬЦКБҝІ»ұдЈ¬ЧЬМе»эІ»ұдЈ¬ФтЖшМеГЬ¶ИКјЦХІ»ұдЈ¬І»ДЬЕР¶ПёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬Ј¬CҙнОуЈ»
DЈ®ёщҫЭЦКБҝКШәг¶ЁВЙЈ¬·ҙУҰЗ°әуИЭЖчДЪЖшМеөДЧЬЦКБҝІ»ұдЈ¬ЧЬМе»эІ»ұдЈ¬»мәПЖшМеөДЖҪҫщПа¶Ф·ЦЧУЦКБҝІ»ФЩ·ўЙъёДұдЈ¬ЛөГчЖшМеөДОпЦКөДБҝІ»ұдЈ¬·ҙУҰҙпЖҪәвЧҙМ¬Ј¬DХэИ·Ј»№Кҙр°ёОӘЈәABDЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВКцКөСйІ»ДЬҙпөҪФӨЖЪКөСйДҝөДөДКЗ
РтәЕ | КөСйДЪИЭ | КөСйДҝөД |
AЈ® | Ҫ«2.5g CuSO4ЎӨ5H2OИЬҪвФЪ97.5g Л®ЦР | ЕдЦЖЦКБҝ·ЦКэОӘ1.6%өДCuSO4ИЬТә |
BЈ® | КТОВПВЈ¬УГpHКФЦҪІв¶ЁЕЁ¶ИОӘ0.1molЎӨLЈӯ1NaClOИЬТәәН0.1molЎӨLЈӯ1CH3COONaИЬТәөДpH | ұИҪПHClOәНCH3COOHөДЛбРФЗҝИх |
CЈ® | ПтКўУР1mLПхЛбТшИЬТәөДКФ№ЬЦРөОјУNaClИЬТәЈ¬ЦБІ»ФЩУРіБөнЙъіЙЈ¬ФЩПтЖдЦРөОјУNa2SИЬТә | ЛөГчТ»ЦЦіБөнДЬЧӘ»ҜОӘБнТ»ЦЦёьДСИЬөДіБөн |
DЈ® | ·ЦұрПт2Ц§КФ№ЬЦРјУИл5mL4ЈҘЎў5mL12ЈҘөД№эСх»ҜЗвИЬТәЈ¬ФЩёчјУИлјёөО0.2molЎӨLЈӯ1FeCl3ИЬТә | СРҫҝЕЁ¶И¶Ф·ҙУҰЛЩВКөДУ°Пм |
A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝAЈЁC2H4Ј©КЗ»щұҫөДУР»ъ»Ҝ№ӨФӯБПЎЈУГAәНіЈјыөДУР»ъОпҝЙәПіЙТ»ЦЦГСАаПгБПәНТ»ЦЦЛхИ©АаПгБПЈ¬ҫЯМеәПіЙВ·ПЯИзНјЛщКҫЈЁІҝ·Ц·ҙУҰМхјюВФИҘЈ©Јә

ТСЦӘЈә +
+![]() Ўъ2ROH+
Ўъ2ROH+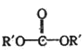
»ШҙрПВБРОКМвЈә
ЈЁ1Ј© BөД·ЦЧУКҪКЗ__________ ЎЈИфDОӘөҘИЎҙъ·јПгЧе»ҜәПОпЗТДЬУлҪрКфДЖ·ҙУҰЈ»ГҝёцD·ЦЧУЦРЦ»ә¬УР1ёцСхФӯЧУЈ¬ DЦРСхФӘЛШөДЦКБҝ·ЦКэФјОӘ13.1%Ј¬ФтDөДҪб№№јтКҪОӘ__________ЎЈ
ЈЁ2Ј© CЦРә¬УРөД№ЩДЬНЕГыіЖКЗ_______________ЎЈўЮөД·ҙУҰАаРНКЗ________________ЎЈ
ЈЁ3Ј©ҫЭұЁөАЈ¬·ҙУҰўЯФЪОўІЁ·шЙдПВЈ¬ТФNaHSO4ЎӨH2OОӘҙЯ»ҜјБҪшРРЈ¬ЗлРҙіцҙЛ·ҙУҰөД»ҜС§·ҪіМКҪЈә___________________________________________________ЎЈ
ЈЁ4Ј©ЗлРҙіцВъЧгПВБРМхјюөДұҪТТИ©өДЛщУРН¬·ЦТм№№МеөДҪб№№јтКҪЈә______________________ЎЈ
i .ә¬УРұҪ»·әН![]() Ҫб№№ ii.әЛҙЕ№ІХсЗвЖЧУР4Чй·еЈ¬ЗТ·еГж»эЦ®ұИОӘ3 : 2 : 2 : 1
Ҫб№№ ii.әЛҙЕ№ІХсЗвЖЧУР4Чй·еЈ¬ЗТ·еГж»эЦ®ұИОӘ3 : 2 : 2 : 1
ЈЁ5Ј©Иф»ҜәПОпEОӘұҪјЧГСөДН¬ПөОпЈ¬ЗТПа¶Ф·ЦЧУЦКБҝұИұҪјЧГСҙу14Ј¬ФтДЬК№FeCl3ИЬТәПФЙ«өДEөДЛщУРН¬·ЦТм№№Ме№ІУРЈЁІ»ҝјВЗБўМеТм№№Ј©__________ЦЦЎЈ
ЈЁ6Ј©ІОХХ өДәПіЙВ·ПЯЈ¬РҙіцУЙ2-ВИұыНйәНұШТӘөДИЬјБЎўОЮ»ъКФјБЦЖұё
өДәПіЙВ·ПЯЈ¬РҙіцУЙ2-ВИұыНйәНұШТӘөДИЬјБЎўОЮ»ъКФјБЦЖұё өДәПіЙБчіМНјЈә_____________________________ЎЈ
өДәПіЙБчіМНјЈә_____________________________ЎЈ
әПіЙБчіМНјКҫАэИзПВЈә![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёЯМъЛбјШ(K2FeO4)КЗТ»ЦЦРВРНЈ¬ёЯР§Ўў¶а№ҰДЬВМЙ«Л®ҙҰАнјБЈ¬ҝЙНЁ№эKClOИЬТәУлFe(NO3)3ИЬТәөД·ҙУҰЦЖұёЎЈ
ТСЦӘЈәўЩKClOФЪҪПёЯОВ¶ИПВ·ўЙъЖз»Ҝ·ҙУҰЙъіЙKClO3
ўЪK2FeO4ҫЯУРПВБРРФЦКЈәҝЙИЬУЪЛ®ЎўОўИЬУЪЕЁKOHИЬТәЈ»ФЪЗҝјоРФИЬТәЦРұИҪПОИ¶ЁЈ»ФЪFe3+ҙЯ»ҜЧчУГПВ·ўЙъ·ЦҪвЈ¬ФЪЛбРФЦБИхјоРФМхјюПВЈ¬ДЬУлЛ®·ҙУҰЙъіЙFe(OH)3әНO2Ј¬ИзНјЛщКҫКЗКөСйКТДЈДв№ӨТөЦЖұёKClOИЬТәЧ°ЦГЎЈ
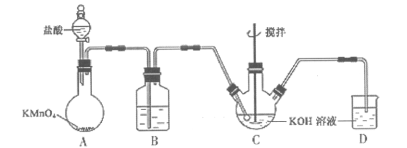
(1)BЧ°ЦГөДЧчУГОӘ______________________Ј»
(2)·ҙУҰКұРиҪ«CЧ°ЦГЦГУЪАдЛ®ФЎЦРЈ¬ЖдФӯТтОӘ__________________Ј»
(3)ЦЖұёK2FeO4КұЈ¬І»ДЬҪ«јоРФөДKClOИЬТәөОјУөҪFe(NO3)3ұҘәНИЬТәЦРЈ¬ЖдФӯТтКЗ________Ј¬ЦЖұёK2FeO4өДАлЧУ·ҪіМКҪ_________________Ј»
(4)№ӨТөЙПіЈУГ·ПМъРјОӘФӯБПЦЖұёFe(NO3)3ИЬТәЈ¬ИЬТәЦРҝЙДЬә¬УРFe2+Ј¬јмСйFe2+ЛщРиКФјБГыіЖ________Ј¬Жд·ҙУҰФӯАнОӘ______________________(УГАлЧУ·ҪіМКҪұнКҫ)Ј»
(5)Пт·ҙУҰәуөДИэҫұЖҝЦРјУИлұҘәНKOHИЬТәЈ¬ОціцK2FeO4№ММеЈ¬№эВЛЎўПҙөУЎўёЙФпЎЈПҙөУІЩЧчЛщУГЧојСКФјБОӘ______________________Ј»
A.Л® B.ОЮЛ®ТТҙј C.ПЎKOHИЬТә
(6)№ӨТөЙПУГЎ°јдҪУөвБҝ·ЁЎұІв¶ЁёЯМъЛбјШөДҙҝ¶ИЈәУГјоРФKIИЬТәИЬҪв1.00g K2FeO4СщЖ·Ј¬өчҪЪpHК№ёЯМъЛбёщИ«Іҝұ»»№ФӯіЙСЗМъАлЧУЈ¬ФЩөчҪЪpHОӘ3Ў«4Ј¬УГ1.0mol/LөДNa2S2O3ұкЧјИЬТәЧчОӘөО¶ЁјБҪшРРөО¶Ё(2Na2S2O3+I2=Na2S4O6+2NaI)Ј¬өн·ЫЧчЦёКҫјБЈ¬Ч°УРNa2S2O3ұкЧјИЬТәөДөО¶Ё№ЬЖрКјәНЦХөг¶БКэИзИзНјЛщКҫЈә
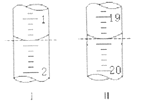
ўЩПыәДNa2S2O3ұкЧјИЬТәөДМе»эОӘ____________mLЎЈ
ўЪФӯСщЖ·ЦРёЯМъЛбјШөДЦКБҝ·ЦКэОӘ_________________ЎЈ[M(K2FeO4)=198g/mol]
ўЫИфФЪЕдЦЖNa2S2O3ұкЧјИЬТәөД№эіМЦР¶ЁИЭКұё©КУҝМ¶ИПЯЈ¬ФтөјЦВЛщІвёЯМъЛбјШөДЦКБҝ·ЦКэ____________(МоЎ°Ж«ёЯЎұЎўЎ°Ж«өНЎұ»тЎ°ОЮУ°ПмЎұ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪТ»¶ЁМхјюПВЈ¬Ҫ«ідВъ NO2 әН O2 өДКФ№Ьө№БўУЪЛ®ІЫЦРЈ¬ід·Ц·ҙУҰәуЈ¬КЈУаЖшМеМе»эОӘФӯ»мәПЖшМеМе»эөД![]() Ј¬ФтФӯ»мәПЖшМеЦР NO2 әНO2 өДМе»эЦ®ұИҝЙДЬКЗЈЁ Ј©
Ј¬ФтФӯ»мәПЖшМеЦР NO2 әНO2 өДМе»эЦ®ұИҝЙДЬКЗЈЁ Ј©
ўЩ8ЎГ1 ўЪ7ЎГ3 ўЫ7ЎГ1 ўЬ4ЎГ1
A.ўЩўЪB.ўЩўЫ
C.ўЪўЫD.ўЪўЬ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРБщЦЦФӘЛШЈ¬ЖдЦРAЎўBЎўCЎўDОӘ¶МЦЬЖЪЦчЧеФӘЛШЈ¬EЎўFОӘөЪЛДЦЬЖЪФӘЛШЈ¬ЛьГЗөДФӯЧУРтКэТАҙОФцҙу.
AФӘЛШФӯЧУөДәЛНвpөзЧУКэұИsөзЧУКэЙЩ3 |
BФӘЛШРОіЙөДОпЦКЦЦАа·ұ¶а.ЖдРОіЙөДТ»ЦЦ№ММеөҘЦК№ӨТөЙПіЈУГЧчЗРёо№ӨҫЯ |
CФӘЛШ»щМ¬ФӯЧУp№мөАУР3ёцОҙіЙ¶ФөзЧУ |
DФӯЧУәЛНвЛщУРp№мөАИ«Въ»т°лВъ |
EФЪёГЦЬЖЪЦРОҙіЙ¶ФөзЧУКэЧо¶а |
FДЬРОіЙәмЙ«ЈЁ»тЧ©әмЙ«Ј©әНәЪЙ«өДБҪЦЦСх»ҜОп |
ДіН¬С§ёщҫЭЙПКцРЕПўЈ¬НЖ¶П
ЈЁ1Ј©»ӯіцA»щМ¬ФӯЧУөДәЛНвөзЧУЕЕІјНј____________________ЎЈ
ЈЁ2Ј©B»щМ¬ФӯЧУөДәЛНвөзЧУЕЕІјНј![]() Ј¬ ёГН¬С§Лщ»ӯөДөзЧУЕЕІјНјОҘұіБЛ____________________________________ЎЈ
Ј¬ ёГН¬С§Лщ»ӯөДөзЧУЕЕІјНјОҘұіБЛ____________________________________ЎЈ
ЈЁ3Ј©D»щМ¬ФӯЧУЦРДЬБҝЧоёЯөДөзЧУЈ¬ЖдөзЧУФЖФЪҝХјдУР____________ёц·ҪПтЈ¬ФӯЧУ№мөАіК____________РОЎЈ
ЈЁ4Ј©РҙіцCФӯЧУөДөзЧУЕЕІјКҪ ____________Ј»РҙіцEФӯЧУөДөзЧУјт»ҜЕЕІјКҪ____________ЎЈ
ЈЁ5Ј©ЗлРҙіцFФӘЛШјЫөзЧУЕЕІјКҪ________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР»ҜС§·ҙУҰөДАлЧУ·ҪіМКҪҙнОуөДКЗ
A.![]() УлСОЛб·ҙУҰ:
УлСОЛб·ҙУҰ:![]()
B.![]() ИЬУЪ№эБҝNaOHИЬТә: Al2O3+2OH-=2AlO2-+H2O
ИЬУЪ№эБҝNaOHИЬТә: Al2O3+2OH-=2AlO2-+H2O
C.ВБИЬУЪЗвСх»ҜДЖИЬТә: 2Al+2OH-+2H2O=2AlO2-+3H2Ўь
D.![]() ИЬУЪNaOHИЬТә:
ИЬУЪNaOHИЬТә:![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝAЎўBЎўCКЗЦРС§»ҜС§ЦРіЈјыөДИэЦЦОпЦКЈ¬ЛьГЗЦ®јдөДПа»ҘЧӘ»Ҝ№ШПөИзПВ(Іҝ·Ц·ҙУҰМхјюј°ІъОпВФИҘ)Јә
![]()
![]()
![]()
![]()
![]()
(1)ИфAКЗТ»ЦЦҪрКфЈ¬CКЗөӯ»ЖЙ«№ММеЈ¬ФтBөД»ҜС§КҪОӘ________________Ј¬AЎъC·ҙУҰөД»ҜС§·ҪіМКҪОӘ________________ЎЈ
(2)ИфAКЗТ»ЦЦ·ЗҪрКфЈ¬ЖдіЈјыөҘЦКОӘәЪЙ«№ММеЈ¬CКЗЧоЦчТӘөДОВКТЖшМеЈ¬ФтCөД·ЦЧУКҪОӘ_______Ј¬BЎъC·ҙУҰөД»ҜС§·ҪіМКҪОӘ____________________________ЎЈAәНCКЗ·сДЬ·ҙУҰЈҝ______(МоЎ°ДЬЎұ»тЎ°І»ДЬЎұ)Ј¬ИфДЬЈ¬Рҙіц·ҙУҰөД»ҜС§·ҪіМКҪЈә____________________(ИфІ»ДЬЈ¬ҙЛҝХІ»Мо)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬ФЪ20.00 mL 0.1000 molЎӨLЈӯ1 NH3ЎӨH2OИЬТәЦРЦрөОөОјУ0.1000 molЎӨLЈӯ1 HClИЬТәЈ¬ИЬТәpHЛжөОИлHClИЬТәМе»эөДұд»ҜЗъПЯИзНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ

A. ўЩИЬТәЈәc(ClЈӯ)>c(NH)>c(OHЈӯ)>c(HЈ«)
B. ўЪИЬТәЈәc(NH)ЈҪc(ClЈӯ)>c(OHЈӯ)ЈҪc(HЈ«)
C. ўЩЎўўЪЎўўЫИэөгЛщКҫөДИЬТәЦРЛ®өДөзАліМ¶ИўЪ>ўЫ>ўЩ
D. өО¶Ё№эіМЦРІ»ҝЙДЬіцПЦЈәc(NH3ЎӨH2O)>c(NH)>c(OHЈӯ)>c(ClЈӯ)>c(HЈ«)
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com