
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向______________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向______________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将______________中(填“增大”、“减小”或“不变”),溶液中 比值______________(填“增大”、“减小”或“不变”).
比值______________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3•H2O的电离常数Kb=______________.
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
下列过程属于固氮的是( )
A.NH3→NO B.NO→NO2 C.N2→NO D.N2→NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
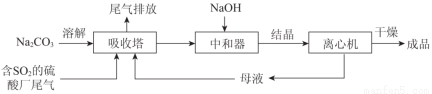
(1)举例说明向大气中排放SO2导致的环境问题:_________。
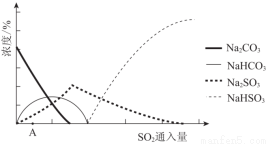
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95 ~100℃加热浓缩,冷却至室温结晶
~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
可逆反应m A(s)+n B(g)  e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
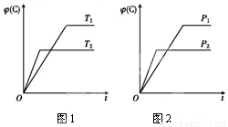
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.二氧化硫可以使溴水褪色是因为它有漂白性
B.浓硫酸可用于干燥H2S和CO2
C.可以用加热法除去NaCl固体中的混有的NH4Cl
D.过量的Cu与浓硝酸反应不可能有一氧化氮生成
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)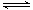 xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
下列有关几种试纸使用的描述中,不正确的是( )
A. 用湿润的红色石蕊试纸检验某种气体是否是NH3
B. 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+
C. 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH
D. 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内有amolA生成的同时生成3amolB;
③A、B、C的浓度不再变化;
④容积不变的密闭容器中混合气体的总压强不再变化;
⑤混合气体的物质的量不再变化;
⑥单位时间消耗amolA,同时生成3amolB ;
⑦A、B、C的分子数目之比为1:3:2。
A.②⑤ B.②⑦ C.①③ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:选择题
下列说法不正确的是
A.对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变 值大于HX溶液的pH改变值
值大于HX溶液的pH改变值
B.在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变
C.在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-)
D.沉淀溶解平衡AgI 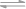 Ag+ + I- 的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
Ag+ + I- 的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com