
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 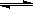 CO2(g)+ H2(g); △H<0。在850℃时,K=1。
CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K ▲ 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向 ▲ (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ▲ 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a ▲ b(填“大于”、“小于”或“等于”)。
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K ▲ 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向 ▲ (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ▲ 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a ▲ b(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省锦州市高三检测二(理综)化学部分 题型:填空题
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3) c(HCO-3)(填“大于”、“小于”或“等于”,)原因是 (用文字叙述)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期阶段检测化学试卷 题型:填空题
“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)  2H2O(l)
△H= -142.9kJ·mol—1
2H2O(l)
△H= -142.9kJ·mol—1
B.H2(g)+1/2 O2(g)  H2O(l)
△H= -285.8kJ·mol—1
H2O(l)
△H= -285.8kJ·mol—1
C.2H2+O2 2H2O(l)
△H= -571.6kJ·mol—1
2H2O(l)
△H= -571.6kJ·mol—1
D.H2(g)+1/2
O2(g)  H2O(g) △H= -285.8kJ·mol—1
H2O(g) △H= -285.8kJ·mol—1
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______________
④2HgO
______________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 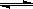 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com