
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
科目:高中化学 来源: 题型:
现有如下两个反应:
A.NaOH + HCl = NaCl + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
今有A、B、C、D、E、F、G、H、I九种气体,已知:①A、B、C三种气体难溶于水,其他气体可溶于水,其中E和I极易溶于水。②将九种气体分别通过NaOH溶液,则D、E、F、G、H气体可被完全吸收。③把以上气体分别通入AgNO3溶液,则D、E、H有沉淀产生。④用强光照射A和D的混合物时发生爆炸,并生成E。⑤E和I接触产生白烟。⑥A跟C在一定条件下可以反应生成I。⑦1mol B完全燃烧可生成1mol G和2mol H2O。⑧1mol H完全燃烧时可生成1mol F和1mol H2O,而2mol H又跟1mol F完全反应生成2mol H2O和一种不溶于水的固体。根据以上实验现象,可以确定A是,B是,C是,D是,E是,F是,G是,H是,I是。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液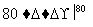 NaClO3溶液
NaClO3溶液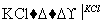 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
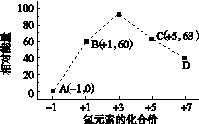
(4)一定条件下,在水溶液中1 mol Cl-、ClO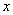 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种金属混合物19.6克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)
的氢气,此金属混合物不可能是
A.Mg和Al B.Al和Fe C.Mg和Cu D.Fe和Zn
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com