
【题目】已知反应2HI(g)![]() H2(g)+I2(g)的能量变化如图所示。下列说法正确的是
H2(g)+I2(g)的能量变化如图所示。下列说法正确的是

A. 0.2molHI充分分解,吸收1.25kJ热量
B. 加入催化剂,Ea减小,△H不变
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. 其他条件不变,增大压强,反应速率加快,HI分解率增大
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 胶体可用于净水,能吸附水中的悬浮物质而沉降
B. 浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C. 利用了丁达尔效应可以区别溶液和胶体
D. Fe(OH)3胶体不稳定,静置后会有沉淀出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中不正确的是
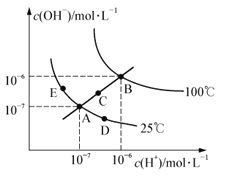
A.图中五点的KW间的关系为:B>C>A=D=E
B.若从A点到D点,可采用:恒温条件下,在水中加入少量的醋酸,提高溶液酸性
C.若从A点到C点,可采用:恒温条件下,在水中加入少量的醋酸铵,促进水的电离
D.100℃时,将pH=2的硫酸与0.01mol·L-1的KOH溶液等体积混合后,溶液中c(H+)=c(OH-)=10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)硫酸钙来源于烟气脱硫、磷酸盐工业和其他工业的副产品,可用于生成硫酸及其硫化物等。硫酸钙在高温下被CO还原,发生的反应有:
I.CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △Hl 平衡常数K1
CaS(s)+4CO2(g) △Hl 平衡常数K1
II.CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
III.3CaSO4(s)+CaS(s) ![]() 4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
(1)△H3=___(用△H1、△H2表示);平衡常数K3=_______(用K1、K2表示)。
(2)上述反应的平衡常数的对数值(lgK)与温度(T)的关系如下图所示:
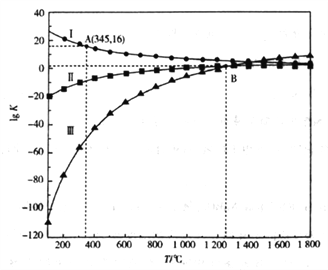
①△H1_________0(填”>”或”<")。
②若只发生反应I,A点c(CO)/c(CO2)=__________(填数值)。
③若只发生反应II和III,B点c(CO)、c(CO2)及c(SO2)之间的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.Na2SiO3易溶于水,可作木材防火剂B.NH3呈碱性,可用作制冷剂
C.Fe粉有还原性,可用作食品抗氧化剂D.漂白粉溶液呈无色,可用作消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com