
【题目】电池在现代社会中具有极其广泛的应用。
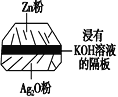
(1)银锌蓄电池(右图)是人造卫星所使用的高能电池之一,其放电时的反应是Zn+Ag2O===ZnO+2Ag。电解质溶液为KOH溶液。则该电池的负极材料是________,放电时正极的电极反应式为________________,放电时负极区的pH________(填“增大”、“减小”或“不变)。
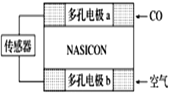
(2)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________________________。正极发生的电极反应式为____________________________________。
【答案】 锌 Ag2O+H2O+2e-===2Ag+2OH- 减小 从b到a CO+O2--2e-===CO2 O2+4e-=2O2-
【解析】(1)总反应中单质Zn失电子被氧化,所以负极为单质锌。负极反应应该为Zn-2e- + 2OH-=ZnO + H2O,用总反应减去负极反应,得到正极反应为:Ag2O+H2O+2e-===2Ag+2OH-。根据上面的负极反应,氢氧根离子被消耗,所以pH减小。
(2)明显是CO的燃料电池,通CO的为负极,通空气的为正极。原电池的内阴离子向负极移动,所以O2-从b到a移动。正极一定是O2得电子,因为传导的是O2-,所以只能是:O2+4e-=2O2-。总反应为2CO + O2 = 2CO2,总反应减去正极反应得到负极反应:CO+O2--2e-===CO2。


科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
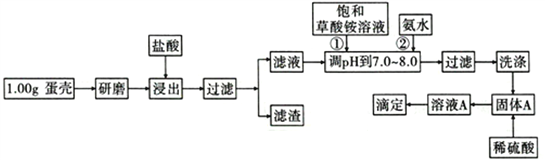
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
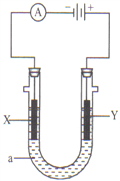
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时, 同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是:______________;在X极附近观察到的现象是:__________________。
②Y电极上的电极反应式是:_____________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_____;
②Y电极的电极反应式是_____________________。(不考虑杂质反应)
(3)若要在铁钉表面镀铜,X电极的材料是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水③溴水.在实验室分离这三种混合物的正确方法依次为( )
A.蒸馏、分液、萃取
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A原子的L电子层比元素B原子的L电子层少 3个电子,B元素原子核外电子总数比A元素原子核外电子总数多5个,则A、B形成的化合物的化学式可能为( )
A.B2A3B.B3A2
C.A2B3D.BA2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制2mol/L的NaCl溶液950mL时应选用的容量瓶的规格和NaCl质量分别是( )
A.950mL 111.2g
B.1000mL 117g
C.1000mL 111.2g
D.950mL 117g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
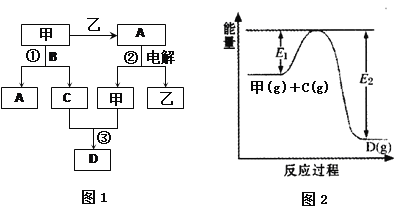
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
molL-1min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com