
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为:2K2S2+KI3 ![]() K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )

A. 闭合K时,K+从右到左通过离子交换膜
B. 闭合K时,A的电极反应式为:3I--2e-===I![]()
C. 闭合K时,X的电极反应式为:2Cl--2e-===Cl2↑
D. 闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L
【答案】D
【解析】
当闭合开关K时,X附近溶液先变红,说明X极生成氢氧根离子,所以在X极上得到电子析出氢气,X极是阴极,发生反应为2H2O+2e-=H2+2OH-,Y极是阳极,发生的反应为2Cl-—2e-=Cl2,与阴极连接的是原电池的负极,所以A极是负极,电极反应为2S22--2e-=S42-,B极是正极,电极反应式为I3-+2e-=3I-。
当闭合开关K时,X附近溶液先变红,即X附近有氢氧根离子生成,所以在X极上得到电子析出氢气,X极是阴极,Y极是阳极,与阴极连接的是原电池的负极,所以A极是负极,B极是正极。A. 闭合K时,形成原电池,阳离子向正极移动,应从左到右通过离子交换膜,所以K+从左到右通过离子交换膜,故错误;B. 闭合K时,A的电极反应式为:2S22--2e-=S42-,故错误;C. 闭合K时,X的电极反应式为:2H2O+2e-=H2+2OH-,故错误;D. 闭合K时,当有0.1 mol K+通过离子交换膜,即当电极Y 有0.1mol电子转移,根据电极反应分析,生成0.05mol氢气,即标准状况下气体1.12 L,故正确。故选D。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
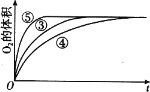
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
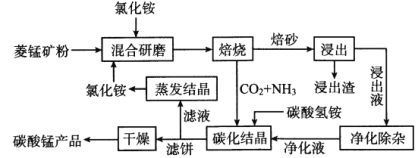
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
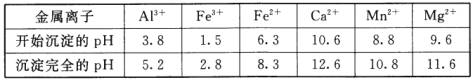
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
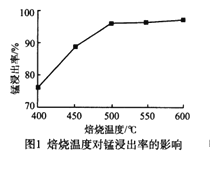
(1)“焙烧”时发生的主要反应的化学方程式为_________。
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度为500℃的原因_________________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中![]() =_________。
=_________。
(3)碳化结晶时,反应的离子方程式为_________。
(4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃—770℃范围内,发生反应的化学方程式为________________________。
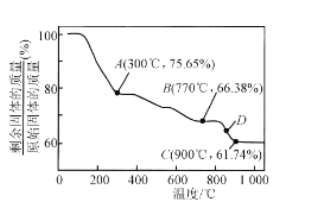
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如图所示.下列说法正确的是
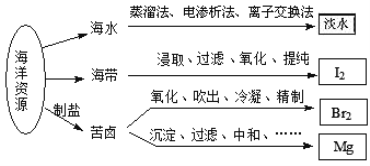
A. 从海水中获取淡水,历史最久的方法是离子交换法
B. 实验室中从海带中获得I2,需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等
C. 用Na2CO3溶液吸收从苦卤中吹出的单质溴时,发生的化学反应可以是3Br2+3Na2CO3═5NaBr+ NaBrO3+3CO2或3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3
D. 用贝壳、盐酸等从苦卤中提取镁时,发生反应的类型有化合、分解、置换和复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池的说法正确的是( )
A.电流从原电池的负极流向正极
B.电子从发生还原反应的电极流出
C.原电池是将化学能转变为电能的一种装置
D.原电池的两个电极,一定是由活动性不同的两种金属组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁原子电池放电时电压高而平稳,电池反应为xMg + Mo3S4 ![]() MgxMo3S4,下列说法错误的是
MgxMo3S4,下列说法错误的是
A. 放电时负极反应为Mg-2e-===Mg2+
B. 充电时阳极反应为Mo3S4+xMg2++2xe-===MgxMo3S4
C. 放电时Mg2+向正极区移动
D. 充电时电池的负极接充电电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
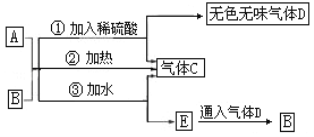
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的 CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式是_______________________。
(2)在一定温度下,向1L密闭恒容容器中充入0.5 mol NO、2 mol CO,发生上述反应,20 s时反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20s内平均反应速率υ(CO)为 ________,平衡时NO的转化率为________ ,混合气体的平均相对分子质量为 ___________。
②在该温度下反应的平衡常数K=__________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.4molCO和0.8mol N2,则此时υ正>υ逆
(3)恒温恒容下,该反应达到平衡的标志是 ________。
A、容器内压强不随时间变化 B、容器内各物质的浓度不随时间变化
C、容器内密度不随时间变化 D、容器内气体平均相对分子质量不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com