
����Ŀ��Ϊ�˼��������Ⱦ����������β���ŷŴ���װ������������װ�á�
��1��ͨ���������������� CO��NO�ڴ������������¿ɷ������淴Ӧ��ת��Ϊ�������ѭ������������壬д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________��
��2����һ���¶��£���1L�ܱպ��������г���0.5 mol NO��2 mol CO������������Ӧ,20 sʱ��Ӧ��ƽ������ʱCO�����ʵ���Ϊ1.6 mol����ش��������⣺
��ǰ20s��ƽ����Ӧ������(CO)Ϊ ________��ƽ��ʱNO��ת����Ϊ________ ����������ƽ����Է�������Ϊ ___________��
���ڸ��¶��·�Ӧ��ƽ�ⳣ��K=__________��
�۹���������Ӧ��������������ȷ����_______�����ţ���
A.�ﵽƽ��ʱ�����߲���CO2��ƽ�⽫�����ƶ�������Ӧ���ʼӿ�
B.��С�����������ƽ�⽫�����ƶ�
C.����ͬ�������£���ʹ�ü״�����ʹ����Ӧ���ʼӿ�105����ʹ���Ҵ�����ʹ�淴Ӧ���ʼӿ�108������Ӧ��ѡ���Ҵ���
D.������ƽ��ʱ���¶Ȳ��䣬���������г���0.4molCO��0.8mol N2�����ʱ����������
��3�����º����£��÷�Ӧ�ﵽƽ��ı�־�� ________��
A��������ѹǿ����ʱ��仯 B�������ڸ����ʵ�Ũ�Ȳ���ʱ��仯
C���������ܶȲ���ʱ��仯 D������������ƽ����Է�����������ʱ��仯
���𰸡�2NO+2CO ![]() N2+ 2CO2 0.02mol��L-1��s-1 80�� 30.9 1.25 AD ABD
N2+ 2CO2 0.02mol��L-1��s-1 80�� 30.9 1.25 AD ABD
��������
��1����NO��CO���Ӧ�����������壬�����ɵ����Ͷ�����̼���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ2NO+2CO![]() N2+2CO2��
N2+2CO2��
��2����һ���¶��£���1L�ܱ������г���0.5mol NO��2mol CO������������Ӧ��20s��Ӧ��ƽ�⣬��ʱCO�����ʵ���Ϊ1.6mol�����ݻ�ѧƽ������ʽ��ʽ���㣺
2NO��g��+2CO��g��![]() N2��g��+2CO2��g��
N2��g��+2CO2��g��
��ʼ����mol�� 0.5 2 0 0
�仯����mol�� 0.4 0.4 0.2 0.4
ƽ������mol�� 0.1 1.6 0.2 0.4
ǰ20s��ƽ����Ӧ�����ԣ�NO��=![]() = 0.02molL��1s��1��ƽ��ʱNO��ת����Ϊ
= 0.02molL��1s��1��ƽ��ʱNO��ת����Ϊ![]() ��100%=80%����������ƽ����Է�������Ϊ
��100%=80%����������ƽ����Է�������Ϊ ![]() =30.9���ʴ�Ϊ��0.02mol��L-1��s-1��80����30.9��
=30.9���ʴ�Ϊ��0.02mol��L-1��s-1��80����30.9��
���Ϊ1L�����ʵ�����ֵΪŨ����ֵ������õ�ƽ�ⳣ��K=![]() =1.25���ʴ�Ϊ:1.25��
=1.25���ʴ�Ϊ:1.25��
��A���ﵽƽ��ʱ�����߲���CO2��ƽ�⽫�����ƶ�������Ӧ���ʼ�С����A����
B����Ӧ�����������С�ķ�Ӧ����С�����������ѹǿ����ƽ�⽫�����ƶ�����B��ȷ��
C�����������淴Ӧ����Ӱ��̶���ͬ������ͬ�������£���ʹ�ü״�����ʹ����Ӧ���ʼӿ�105����ʹ���Ҵ�����ʹ�淴Ӧ���ʼӿ�108������Ӧ��ѡ���Ҵ�������C��ȷ��
D��������ƽ��ʱ���¶Ⱥ�ѹǿ���䣬���������г���0.4molCO��0.8mol N2��Ũ����Qc=![]() =4��K��ƽ��������У����ʱ���������� ����D���ʴ�Ϊ��AD��
=4��K��ƽ��������У����ʱ���������� ����D���ʴ�Ϊ��AD��
��3��A.�ں��º��������£����ڸ÷�ӦΪ�ǵ�����Ŀ��淴Ӧ��������ѹǿ����ʱ��仯˵����Ӧ�ﵽƽ��״̬��B.�����ڸ����ʵ�Ũ�Ȳ���ʱ��仯˵�����淴Ӧ�ﵽƽ��״̬��C.������������������䣬������������䣬���������ܶȲ���ʱ��仯�����ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬��D.�ں��º��������£����ڸ÷�ӦΪ�ǵ�����Ŀ��淴Ӧ��������������ƽ����Է�����������ʱ��仯��˵����Ӧ�ﵽƽ��״̬���ʴ�Ϊ��ABD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ��(��)Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K��ͨ�����õ�س�ŵ�Ļ�ѧ����ʽΪ��2K2S2��KI3 ![]() K2S4��3KI��װ��(��)Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ��X������Һ�ȱ�졣������˵����ȷ����(����)
K2S4��3KI��װ��(��)Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ��X������Һ�ȱ�졣������˵����ȷ����(����)

A. �պ�Kʱ��K�����ҵ���ͨ�����ӽ���Ĥ
B. �պ�Kʱ��A�ĵ缫��ӦʽΪ��3I����2e��===I![]()
C. �պ�Kʱ��X�ĵ缫��ӦʽΪ��2Cl����2e��===Cl2��
D. �պ�Kʱ������0.1 mol K��ͨ�����ӽ���Ĥ��X�缫�ϲ�����״��������1.12 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������ĩ�����ܺ���![]() ��KOH��
��KOH��![]() ��
��![]() ��
��![]() �е�һ�ֻ��֡�ijͬѧΪ̽�������ĩ����ɣ�ȡ������Ʒ��������ʵ�顣
�е�һ�ֻ��֡�ijͬѧΪ̽�������ĩ����ɣ�ȡ������Ʒ��������ʵ�顣

����˵������ȷ����![]()
![]()
A. �����ĩ��һ������KOH
B. �����ĩ��һ������![]() ��
��![]()
C. ȡ��Һ1�ȼ����������ữ���ټ��Ȼ�����Һ����δ������ɫ����������Ʒ����������
D. Ϊ��һ��ȷ��ԭ��Ʒ��ɣ����������2�м���NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ħ������Ϊ
A.16gB.1 mol��L��1C.22.4 L��mol��1D.32g��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��̼����Ԫ��������Ϊ24��5��D�뺬NaOH��Cu(OH)2����Һ�ڼ��������·�Ӧ���õ�ש��ɫ������FΪ����Ũ����ζ����������ˮ����״Һ�壬��RCl+NaOH![]() ROH+NaCl����ת����ϵ��ͼ��ʾ��
ROH+NaCl����ת����ϵ��ͼ��ʾ��
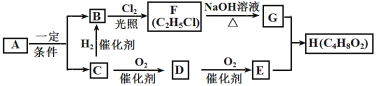
��ش�
��1��E�й����ŵ�����______��
��2��C��B�ķ�Ӧ����_______��
��3��D��E�Ļ�ѧ����ʽ��______��
��4��H��NaOH��Һ��Ӧ�ķ���ʽ_______��
��5������˵������ȷ����_______��
A.��ҵ��ͨ��ʯ���ѽ��ʵ��A��B+C
B.����ֲ��ո���һ��������ͨ��ˮ�ⷴӦ����ֱ�ӵõ��л���G
C.����Na2CO3��Һ����D��G
D.��ȫȼ�յ����ʵ�����C��D��E����O2�������μ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.2molY���������ݻ�Ϊ2L�������У�ʹ�䷢�����·�Ӧ��3X��g��+Y��g��=nZ��g��+2W��g����5minĩ����0.2molW������֪��ZŨ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/ (L�� min)������ֵΪ
A. 4B. 3C. 2D. 1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ����ȷ����
A. Al2(SO4)3��2Al3����3SO42�� B. Na2SO4��2Na����SO4��2
C. Ca(NO3)2��Ca2����2(NO3)2�� D. Ba(OH)2��Ba2����OH2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Գ��˵����ӦP(g)+Q(g)![]() R(g)+S(g)�ں������Ѵﵽƽ����ǣ� ��
R(g)+S(g)�ں������Ѵﵽƽ����ǣ� ��
A. ��Ӧ�����ڵ�ѹǿ����ʱ��ı�
B. ��Ӧ������P��Q��R��S����Ũ��֮��Ϊ1:1:1:1
C. P���������ʺ�S�������������
D. ��Ӧ�����ڵ����������ʵ�������ʱ��仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Լռ����������71%�����俪�����õIJ���������ͼ��ʾ������˵������ģ� ��

���Լ�1����ѡ��NaOH��Һ��
�ڴӿ�±����ȡBr2�ķ�Ӧ�����ӷ���ʽΪ��2Br-+Cl2=Br2+2Cl-
�۹�ҵ�ϣ��������MgOұ������þ�ɼ�С�ܺģ�
����������ҵ�ϵ�������Ȼ������Ʊ�����
�����ƣ���ⱥ��NaCl��Һ��
��������CO�ڸ����»�ԭ����ʯ�е���
A. �٢ڢܢ�B. �ڢۢܢ�C. �٢ۢܢ�D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com