
【题目】下列各组离子在溶液中能大量共存的是( )
A. NH4+、SO42-、NO3- B. Ba2+、SO42-、NO3-
C. Na+、H+、HCO3- D. NH4+、OH-、Cl-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.含有离子键的化合物一定是离子化合物
B.非金属之间形成的化学键不一定是共价键
C.含有共价键的化合物不一定是共价化合物
D.在共价化合物中也可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如图所示装置进行实验。
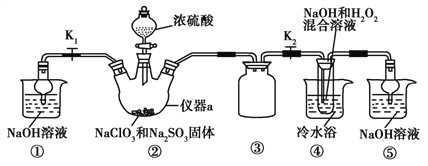
(1)仪器a的名称为____,装置①的作用是____,装置③的作用是______。
(2)装置②中产生ClO2,涉及反应的化学方程式为________________;装置④中反应生成NaClO2的化学方程式为_______________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,_____________________。
(5)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度_____。(提示:2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
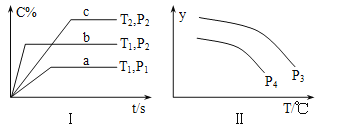
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电。电池的工作原理为:LiMO2+nC![]() Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示。下列有关说法正确的是
Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示。下列有关说法正确的是
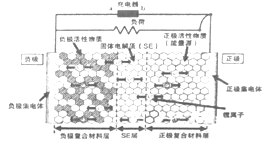
A. 电池放电时,负极发生的反应为:nC+xLi++xe-=LixCn
B. 充电器的a 端接电源的负极,b端接电源的正极
C. 电池充电时Li+自左向右移动
D. 电池工作时,固体电解质因熔融而导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年科学家首次利用X射线现测到化学反应过渡态的形成。在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是
A. CO与CO2均为酸性氧化物
B. 大量CO2的排放可导致酸雨的形成
C. CO与O形成化学键过程中有电子转移
D. 固体催化剂的使用会降低该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)乙烯的电子式为______________;
(2)当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成
2,2-二甲基丁烷,则A的结构简式为______________________________。
(3)某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2反应,则该烃的结构简式为______________________。
(4)相对分子质量为72且沸点最低的烷烃的结构简式_______________________;
(5)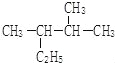 的名称(系统命名法)_______________________。
的名称(系统命名法)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
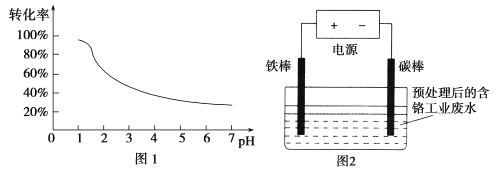
【题目】工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
有关数据如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 |
开始沉淀的pH | 1.9 | 7.5 | 4.3 |
完全沉淀的pH | 3.4 | 9.7 | 7.6 |
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是 。
(2)电解过程中阳极质量减小,阴极有气体产生,写出两极的电极反应式:
阳极 ,阴极 。
(3)写出Cr2O72-转化为Cr3+的离子方程式: 。
(4)每处理1molCr2O72-,外电路中转移 mol电子。
(5)电解过程中解液的pH (填增大、减小或不变)
(6)处理过程中,当废水颜色不再发生明显变化时,切断电源,取出电极。此时,溶液中的阳离子有Fe2+、Fe3+、Cr3+,若想用调节pH的方法得到纯净的Cr(OH)3沉淀,应先向溶液中加入适量的 ,再调节pH= ,过滤后继续调节pH= 8。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com