
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
分析 (1)根据原子核外电子排布式知,该原子核外电子数为16,为硫元素,其氢化物为硫化氢,根据硫原子的价层电子对数判断原子杂化方式,其最高价氧化物对应的水化物是硫酸;
(2)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,故E为Mg;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,故F为Cl;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,据此解答.
解答 解:(1)根据原子核外电子排布式知,该原子核外电子数为16,所以该元素是S,其氢化物为硫化氢,化学式为H2S,分子中S原子的价层电子对数为$\frac{6+2}{2}$=4,所以硫原子按sp3方式杂化,硫化氢分子中有两对孤电子对,所以是极性分子,硫的最高价氧化物的水化物化学式为H2SO4,
故答案为:S;H2S;sp3;极性;H2SO4;
(2)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,故E为Mg;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,故F为Cl;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3.
①C单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ,F为Cl元素,原子的电子排布式为1s22s22p63s23p5,E为Mg元素,原子结构示意图是
,F为Cl元素,原子的电子排布式为1s22s22p63s23p5,E为Mg元素,原子结构示意图是 ,
,
故答案为: ;1s22s22p63s23p5;
;1s22s22p63s23p5; ;
;
②化合物乙为NH4NO3,含有的化学键有:离子键、共价键、配位键,
故答案为:离子键、共价键、配位键;
③化合物甲为CO2,固体时属于分子晶体,Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:分子;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,有利于基础知识的巩固.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲在空气中燃烧时发出明亮的火焰,并伴有黑烟 | |
| B. | SO2使溴水褪色与乙使KMnO4溶液褪色的原理相同 | |
| C. | 丙中的碳碳键的夹角为109°28′ | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应并断裂碳氧键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①④ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的产量是一个国家石油化工水平的重要标志,工业上主要来源于石油的裂解 | |
| B. | 甲醇也称木醇,无色易挥发液体,有毒.含有甲醇的工业酒精不可饮用 | |
| C. | 甲醛通常条件下是一种无色、有刺激性气味的液体,工业上可用于制取酚醛树脂等 | |
| D. | 苯酚又称石炭酸,无色晶体,有毒,可以用作杀菌消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 纯A (单质) | B(溶液) | C(固体) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 棕黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要加入过量的氧气 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是27 | B. | 中子数是27 | C. | 电子数是13 | D. | 质量数是13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
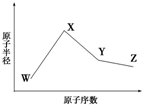 已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com