

| A. | 甲在空气中燃烧时发出明亮的火焰,并伴有黑烟 | |
| B. | SO2使溴水褪色与乙使KMnO4溶液褪色的原理相同 | |
| C. | 丙中的碳碳键的夹角为109°28′ | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应并断裂碳氧键 |
分析 由图可知,甲为甲烷,乙为乙烯,丙为苯,丁为乙醇.
A.甲烷燃烧为淡蓝色火焰;
B.乙烯中含双键;
C.苯为正六边形;
D.乙醇与乙酸发生酯化反应需要浓硫酸作催化剂.
解答 解:由图可知,甲为甲烷,乙为乙烯,丙为苯,丁为乙醇.
A.甲烷中含C量较低,燃烧时为淡蓝色火焰,故A错误;
B.乙烯中含双键,则与高锰酸钾发生氧化反应使其褪色,二氧化硫与溴水发生氧化反应使其褪色,两者原理相同,故B正确;
C.苯为正六边形,碳碳键的夹角是120°,故C错误;
D.乙醇与乙酸发生酯化反应的条件是浓硫酸,且断裂O-H键,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握比例模型及对应化合物的性质为解答的关键,侧重常见几种烃和乙醇性质及结构的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
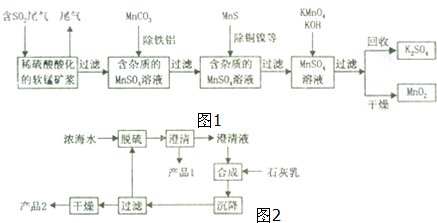
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
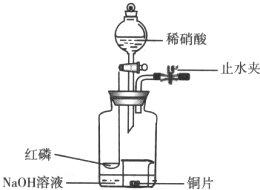 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水 | B. | 淀粉溶液 | C. | FeCl3溶液 | D. | 新制氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两元素能形成阴阳离子个数比都是1:2的化合物Y2X、Y2X2 | |
| B. | Z的简单离子在同周期元素所形成的简单离子中半径最小,Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应 | |
| C. | Y、Z所在周期的所有元素中Y的金属性最强,工业上通过电解其熔融氯化物得到Y单质 | |
| D. | X元素形成的单质存在同素异形现象,其中以X2单质最为常见且氧化性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基丁烷 | B. | 2-甲基丁烷 | C. | 3-甲基戊烷 | D. | 2,2-甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有④ | C. | ①和④ | D. | ①和⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com