
【题目】NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,11.2 L的己烷所含的分子数为0.5NA
B.28 g乙烯所含共用电子对数目为6NA
C.11.2L一氯甲烷所含分子数为0.5NA
D.1mol甲基所含的电子总数为9NA
科目:高中化学 来源: 题型:
【题目】工业上用氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
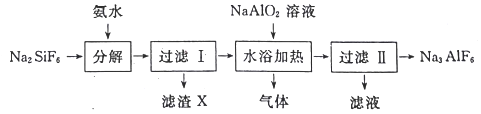
(1)分解过程发生的反应为:Na2SiF6+4NH3H2O═2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为______________________。
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图所示,分解时需要控制溶液的pH=________;能提高其分解速率的措施有___________ (填标号)。
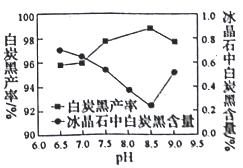
A.快速搅拌B.加热混合液至100℃C.降低氨水浓度
(3)流程中可循环利用的物质为_________(写化学式);冰晶石在电解冶炼铝中的作用是降低氧化铝的熔融温度、________________________和提髙产率。
(4)水浴加热过程中生成冰晶石的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解池的说法正确的是
A.电源的负极就是阴极
B.阳极上发生还原反应
C.与直流电源正极相连的电极是电解池的阳极
D.与直流电源负极相连的电极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于5mL 14mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g 沉淀.下列说 法不正确的是
A. 该合金中铜与镁的物质的量之比是2:l
B. 得到2.54g 沉淀时,加入NaOH 溶液的体积是600mL
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 与铜镁合金反应的HNO3的物质的量为0.12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 增大反应物浓度使单位体积内活化分子数和活化分子百分数均增加,有效碰撞增多,反应速率加快
B. 升高温度使单位体积内活化分子百分数大大增加,正反应速率增加,逆反应速率降低
C. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D. 增大压强一定能使单位体积内活化分子数增加有效碰撞增多,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,某化学反应:2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 900℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 900℃ | 1.0 | 0.60 | C2 | C2 | C2 | C2 | C2 |
3 | 900℃ | C3 | 0.77 | 0.65 | 0.55 | 0.45 | 0.40 | 0.40 |
4 | 920℃ | 1.0 | 0.90 | 0.77 | 0.67 | 0.60 | 0.60 | 0.60 |
根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速度为________mol/(L·min)。
(2)在实验2,反应经20分钟就达到了平衡。则A的平衡浓度C2=________mol/L,你判断的依据是____________;对比实验1和实验2,实验2中隐含的反应条件是________。
(3)比较实验4和实验1,可推测该反应的△H________零。(填>、=、<)原因是:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将各2amol的P、Q、R、S在一密闭容器中混合,发生如下反应:xP+yQ![]() zR+wS。达到平衡后,测得n(P)a mol,n(Q)
zR+wS。达到平衡后,测得n(P)a mol,n(Q) ![]() mol,n(R)
mol,n(R) ![]() mol, n(S)3a mol,已知四种物质中只有R是固体。
mol, n(S)3a mol,已知四种物质中只有R是固体。
(1)若该反应中物质的化学计量数x==2,则w==_________。
(2)达到平衡时,P的转化率是____________________。
(3)如果只改变压强,化学反应速率变化,但化学平衡不移动,则该反应中各物质的聚集状态分别是:Q______,S==_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于油脂在人体中的生理功能的理解中错误的是( )
A. 油脂在人体内的水解、氧化可释放能量,所以油脂可在人体内提供能量
B. 为人体合成其它化合物提供原料
C. 保持体温,保护内脏器官
D. 促进水溶性维生素B族、维生素C等的吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
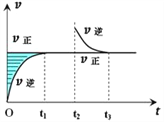
A. Z和W在该条件下一定不为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com