
【题目】在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置确认该混合气体中是否含有SO2和C2H4。请回答下列问题:
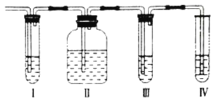
⑴上述Ⅰ、Ⅳ装置可盛放的试剂是:Ⅰ____;Ⅳ___;(请将下列有关试剂的序号填入对应装置内,可重复选用)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
⑵能说明SO2气体存在的现象是________
⑶使用装置Ⅱ的目的是_______;有关反应的离子方程式是_____。
⑷确定含有乙烯的现象是_______。
⑸为了制备重要的有机原料氯乙烷(CH3CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备;
乙同学:选乙烯和适量HCl在一定条件下制备。
你认为上述两位同学的方案中,合理的是______的方案。
【答案】A D Ⅰ中品红溶液褪色 除去二氧化硫 SO2+2OH-=SO32-+H2O Ⅲ中品红溶液不褪色,Ⅳ中酸性KMnO4溶液褪色 乙同学
【解析】
实验室用电石与饱和食盐水制备乙烯,乙烯具有碳碳双键,能与溴水发生加成反应,与酸性高锰酸钾发生氧化反应;副产物二氧化硫具有还原性和漂白性,能使品红溶液褪色,能与酸性高锰酸钾反应使其褪色。
⑴根据产物性质,首先应检验二氧化硫存在,并彻底吸收后,检验乙烯存在。Ⅰ装置可盛放品红溶液,Ⅱ装置可盛放氢氧化钠,Ⅲ装置可盛放品红溶液,检验是否除尽二氧化硫,Ⅳ装置可盛放酸性高锰酸钾,最终检验乙烯的存在。
⑵二氧化硫具有漂白性,能说明SO2气体存在的现象是Ⅰ中品红溶液褪色;
⑶装置Ⅱ中为氢氧化钠,目的是除去二氧化硫;有关反应的离子方程式是SO2+2OH-=SO32-+H2O。
⑷确定含有乙烯要保证二氧化硫全部除尽,即现象是Ⅲ中品红溶液不褪色,Ⅳ中酸性KMnO4溶液褪色。
⑸制备氯乙烷(CH3CH2Cl),甲同学:选乙烷和适量氯气在光照条件下制备,产物多样,难以控制反应产物为一氯代物;乙同学:选乙烯和适量HCl在一定条件下制备,发生加成反应,产物唯一,产率高。上述两位同学的方案中,合理的是乙同学的方案。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z可用于防治骨质疏松,可通过X、Y经两步转化得到Z。下列说法正确的是( )
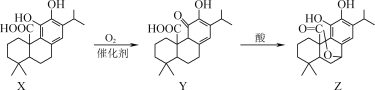
A. X、Y、Z都属于芳香族化合物
B. Y分子中含有3个手性碳原子
C. X、Y、Z与浓溴水反应最多消耗1molBr2
D. 1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
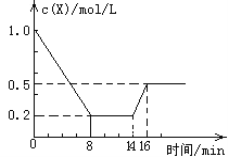
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构分别如下图所示。下列有关叙述不正确的是
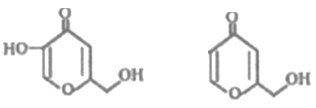
A.曲酸分子中所有碳原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸和脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑O-O键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
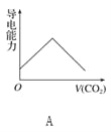
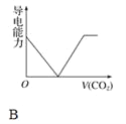

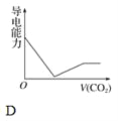
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小祖的同学设计利用C2H2气体制取H2C2O42H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用如图装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是____________________________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为________________________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如图所示:

①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为___________________________________。
③从装置D中得到产品,还需经过__________________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol/L酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定时高锰酸钾标准溶液盛放在滴定管中_____________(填“酸式”或“碱式”)。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是______________ 。
③产品中H2C2O4·2H2O的质量分数为_________________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示.下列说法不正确的是( )

A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.10mol/L MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究硝酸的性质设计并完成如下实验:
a、某兴趣小组设计如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞 b,试管 d 中加水至浸没长导管口,塞紧试管 c 和 d 的胶塞,加热 c,其目的是__________
(2)在 d 中加适量 NaOH 溶液,c 中放一小块铜片,由分液漏斗 a 向 c 中加入2mL 浓硝酸,c 中反应的离子方程式___________________________________________;再由 a 向 c 中加 2mL 蒸馏水、写出 c 中可能进行的两个反应的化学方程式_______________________________________;________________________________________.
b、室温下,将铁片分别置于适量的稀 HNO3 和浓 HNO3 中(如图所示)。

(1)气球的作用是_____________________________________
(2)A中溶液最终变为浅绿色,发生反应的离子方程式是______________________
(3)B 中无明显变化,该同学进一步探究如下:假设①常温下铁与浓硝酸不反应。②_______________________
进行实验:将 B 中的铁片取出并洗净后,放入 CuSO4 溶液中,无明显变化, 则说明假设①_____________(填“成立”或“不成立”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com