
| A、0.1(2a-b)mol/L |
| B、0.1(b-2a)mol/L |
| C、10(b-2a)mol/L |
| D、10(2a-b)mol/L |
| (b-2a)mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及其离子方程式 | 评价 | |
| A | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸:CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
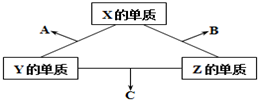 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com